题目内容
12.设NA为阿伏加德罗常数的值.下列说法正确的是( )| A. | 等物质的量的O2和CO2所含氧原子数均为2NA | |
| B. | 标准状况下,2.24 L一氯甲烷中含有氢原子数目为0.3NA | |
| C. | 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3mol I2转移的电子数为6NA | |
| D. | 6.8 g熔融的KHSO4中含有0.1 NA个阳离子 |
分析 A.等物质的量的O2和CO2所含氧原子数相同,1mol氧气和1molCO2含氧原子数为2NA ;
B.标准状况下气体摩尔体积为22.4L/mol,计算n=$\frac{V}{22.4}$mol;
C.I元素的化合价由+5价降低为0,I元素的化合价由-1价升高为0,转移5e-;
D.计算6.8g硫酸氢钾物质的量n=$\frac{m}{M}$,熔融的KHSO4中电离出钾离子和硫酸氢根离子.
解答 解:A.等物质的量的O2和CO2所含氧原子数相同,物质的量不是1mol,所含氧原子数不是2NA,故A错误;
B.标准状况下,2.24 L一氯甲烷物质的量=$\frac{2.24L}{22.4L/mol}$=0.1mol,所以一氯甲烷含有氢原子数目为0.3NA ,故B正确;
C.在反应KIO3+6HI=KI+3I2+3H2O中,I元素的化合价由+5价降低为0,I元素的化合价由-1价升高为0,生成3mo1I2转移的电子数为5NA,故C错误;
D.计算6.8g硫酸氢钾物质的量n=$\frac{m}{M}$=$\frac{6.8g}{136g/mol}$=0.05mol,熔融的KHSO4中电离出钾离子和硫酸氢根离子,含有0.05 NA个阳离子,故D错误;
故选B.
点评 本题考查了阿伏伽德罗常数的分析应用,主要是气体摩尔体积条件应用,氧化还原反应电子转移计算,注意硫酸氢钾熔融电离硫酸氢根离子和钾离子,题目难度中等.

练习册系列答案
相关题目
2.关于如图中各装置的叙述正确的是( )
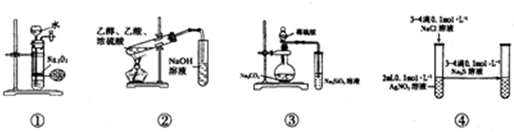

| A. | 装置①可制备少量氧气 | |
| B. | 装置②可用于实验室制取和收集乙酸乙酯 | |
| C. | 装置③的实验可推断硫、碳、硅三种元素的非金属强弱 | |
| D. | 装置④能验证AgCl沉淀可转化为溶解度更小的Ag2S沉淀 |
17.《天工开物》第七卷《陶埏(陶瓷)》中“水火既济而土合.…后世方土效灵,人工表异,陶成雅器,有素肌、玉骨之象焉”所述的“陶成雅器”的主要原料是( )
| A. | 黏土 | B. | 纯碱、石灰石、石英砂 | ||
| C. | 黏土、石灰石 | D. | 二氧化硅、硅酸钙、硅酸铝 |
4.工业合成尿素反应为:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)
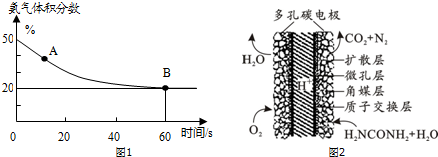
(1)在一个真空恒容密闭容器中充入CO2和NH3发生上述反应合成尿素,恒定温度下混合气体中的氨气含量如图1所示.A点的正反应速率与B点的逆反应速率的关系:v正(CO2)>v逆(CO2)(填“>”、“<”或“=”)
(2)氨基甲酸铵是合成尿素的一种中间产物.将体积比为2:1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生下列反应并达到平衡:2NH3(g)+CO2(g)?NH2COONH4(s)
将实验测得的不同温度下的平衡数据列于下表:
①关于上述反应的焓变、熵变说法正确的是A
A.△H<0,△S<0B.△H>0,△S<0
C.△H>0,△S>0D.△H<0,△S>0
②关于上述反应的平衡状态下列说法正确的是C
A.分离出少量的氨基甲酸铵,反应物的转化率将增大
B.平衡时降低体系温度,CO2的体积分数下降
C.NH3的转化率始终等于CO2的转化率
D.加入有效的催化剂能够提高氨基甲酸铵的产率
(3)化学家正在研究尿素动力燃料电池,尿液也能发电.用这种电池直接去除城市废水中的尿素,既能产生净化的水又能发电.尿素燃料电池结构如图2所示,写出该电池的负极反应式CO(NH2)2+H2O-6e-═N2↑+CO2↑+6H+.
(1)在一个真空恒容密闭容器中充入CO2和NH3发生上述反应合成尿素,恒定温度下混合气体中的氨气含量如图1所示.A点的正反应速率与B点的逆反应速率的关系:v正(CO2)>v逆(CO2)(填“>”、“<”或“=”)

(2)氨基甲酸铵是合成尿素的一种中间产物.将体积比为2:1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生下列反应并达到平衡:2NH3(g)+CO2(g)?NH2COONH4(s)
将实验测得的不同温度下的平衡数据列于下表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度 (10-3mol•L-1) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A.△H<0,△S<0B.△H>0,△S<0
C.△H>0,△S>0D.△H<0,△S>0
②关于上述反应的平衡状态下列说法正确的是C
A.分离出少量的氨基甲酸铵,反应物的转化率将增大
B.平衡时降低体系温度,CO2的体积分数下降
C.NH3的转化率始终等于CO2的转化率
D.加入有效的催化剂能够提高氨基甲酸铵的产率
(3)化学家正在研究尿素动力燃料电池,尿液也能发电.用这种电池直接去除城市废水中的尿素,既能产生净化的水又能发电.尿素燃料电池结构如图2所示,写出该电池的负极反应式CO(NH2)2+H2O-6e-═N2↑+CO2↑+6H+.
1.下列有关说法正确的是( )
| A. | 铅蓄电池放电过程中,正极质量增加,负极质量减小 | |
| B. | 反应NH4Cl(s)=NH3(g)+HCl(g)在室温下不能自发进行,则该反应的△H>0 | |
| C. | 一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率 | |
| D. | 0.1 mol•L-1 CH3COOH溶液加水稀释后,溶液中c(OH-)、CH3COOH浓度均减少 |
 )是一种名贵的香料,又是合成VE、VA、紫罗兰酮、胡萝卜素等的中间体.合成芳樟醇的一种方法如下:
)是一种名贵的香料,又是合成VE、VA、紫罗兰酮、胡萝卜素等的中间体.合成芳樟醇的一种方法如下: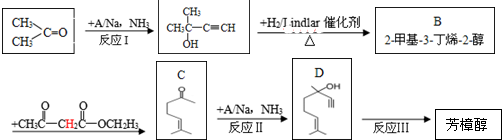
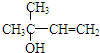 ,C分子中的官能团名称为羰基、碳碳双键,已知反应I和反应Ⅱ的原子利用率100%,则A的结构简式为HC≡CH.
,C分子中的官能团名称为羰基、碳碳双键,已知反应I和反应Ⅱ的原子利用率100%,则A的结构简式为HC≡CH.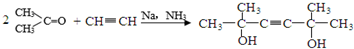 .
. ,写出柠檬醛的另一种同分异构体的结构简式(不改变分子中原子的连接方式)
,写出柠檬醛的另一种同分异构体的结构简式(不改变分子中原子的连接方式)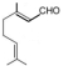 ;芳樟醇在H+作用下也可异构化为香叶醇(
;芳樟醇在H+作用下也可异构化为香叶醇(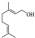 ).下列有关柠檬醛的下列说法正确的是BCD
).下列有关柠檬醛的下列说法正确的是BCD ;三溴化磷
;三溴化磷 .
.
 .
. .
. )的合成路线:
)的合成路线: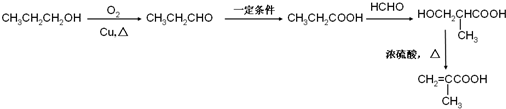 .
.