题目内容
13.某种微生物电池,其工作原理示意图如图,下列说法不正确的是( )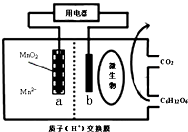
| A. | H+向左移动 | |
| B. | 电子由a极沿导线流向b极 | |
| C. | b极电极反应式为:C6H12O6-24e-+6H2O=6CO2+24H+ | |
| D. | 当电路中转移0.2mole-时,a极质量减少8.7g |
分析 根据图知,通入有机物的一极b为负极,失去时电子发生氧化反应,反应为C6H12O6-24e-+6H2O=6CO2+24H+,a极为正极,得电子发生还原反应,阳离子向正极移动,电子由负极经导线流到正极,根据电极反应计算a极质量的减轻,据此分析解答.
解答 解:根据图知,通入有机物的一极b为负极,失去时电子发生氧化反应,反应为C6H12O6-24e-+6H2O=6CO2+24H+,a极为正极,得电子发生还原反应,阳离子向正极移动,电子由负极经导线流到正极,根据电极反应计算a极质量的减轻,
A.通过以上分析知,b是负极、a是正极,阳离子向正极移动,故A正确;
B.电子由负极经导线流到正极,即为由b移向正极a,故B错误;
C.b为负极,失去时电子发生氧化反应,反应为C6H12O6-24e-+6H2O=6CO2+24H+,故C正确;
D.当电路中转移0.2mole-时,有0.1mol二氧化锰溶解,即a极质量减少8.7,故D正确;
故选B.
点评 本题考查了原电池原理,根据元素化合价变化判断正负极,再结合反应物、生成物及得失电子书写电极反应式,注意书写电极反应式时要结合电解质特点,根据得失电子数目计算减轻的质量,难度不大.

练习册系列答案
相关题目
4.工业合成尿素反应为:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)
(1)在一个真空恒容密闭容器中充入CO2和NH3发生上述反应合成尿素,恒定温度下混合气体中的氨气含量如图1所示.A点的正反应速率与B点的逆反应速率的关系:v正(CO2)>v逆(CO2)(填“>”、“<”或“=”)
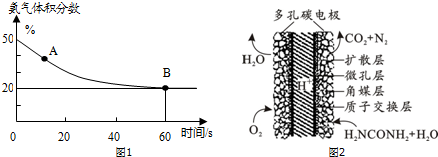
(2)氨基甲酸铵是合成尿素的一种中间产物.将体积比为2:1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生下列反应并达到平衡:2NH3(g)+CO2(g)?NH2COONH4(s)
将实验测得的不同温度下的平衡数据列于下表:
①关于上述反应的焓变、熵变说法正确的是A
A.△H<0,△S<0B.△H>0,△S<0
C.△H>0,△S>0D.△H<0,△S>0
②关于上述反应的平衡状态下列说法正确的是C
A.分离出少量的氨基甲酸铵,反应物的转化率将增大
B.平衡时降低体系温度,CO2的体积分数下降
C.NH3的转化率始终等于CO2的转化率
D.加入有效的催化剂能够提高氨基甲酸铵的产率
(3)化学家正在研究尿素动力燃料电池,尿液也能发电.用这种电池直接去除城市废水中的尿素,既能产生净化的水又能发电.尿素燃料电池结构如图2所示,写出该电池的负极反应式CO(NH2)2+H2O-6e-═N2↑+CO2↑+6H+.
(1)在一个真空恒容密闭容器中充入CO2和NH3发生上述反应合成尿素,恒定温度下混合气体中的氨气含量如图1所示.A点的正反应速率与B点的逆反应速率的关系:v正(CO2)>v逆(CO2)(填“>”、“<”或“=”)

(2)氨基甲酸铵是合成尿素的一种中间产物.将体积比为2:1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生下列反应并达到平衡:2NH3(g)+CO2(g)?NH2COONH4(s)
将实验测得的不同温度下的平衡数据列于下表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度 (10-3mol•L-1) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A.△H<0,△S<0B.△H>0,△S<0
C.△H>0,△S>0D.△H<0,△S>0
②关于上述反应的平衡状态下列说法正确的是C
A.分离出少量的氨基甲酸铵,反应物的转化率将增大
B.平衡时降低体系温度,CO2的体积分数下降
C.NH3的转化率始终等于CO2的转化率
D.加入有效的催化剂能够提高氨基甲酸铵的产率
(3)化学家正在研究尿素动力燃料电池,尿液也能发电.用这种电池直接去除城市废水中的尿素,既能产生净化的水又能发电.尿素燃料电池结构如图2所示,写出该电池的负极反应式CO(NH2)2+H2O-6e-═N2↑+CO2↑+6H+.
1.下列有关说法正确的是( )
| A. | 铅蓄电池放电过程中,正极质量增加,负极质量减小 | |
| B. | 反应NH4Cl(s)=NH3(g)+HCl(g)在室温下不能自发进行,则该反应的△H>0 | |
| C. | 一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率 | |
| D. | 0.1 mol•L-1 CH3COOH溶液加水稀释后,溶液中c(OH-)、CH3COOH浓度均减少 |
8.已知W、X、Y、Z、R是短周期中原子序数依次增大的5种主族元素,其中W、Z同族,且原子序数相差8,元素X在同周期的主族元素中原子半径最大,Y是地壳中含量最多的金属元素.下列说法中正确的是( )
| A. | 气态氢化物稳定性:R>Z>W | |
| B. | 原子半径:R<W<Y<Z<X | |
| C. | X分别与W、R形成的化合物的化学键类型不一定相同 | |
| D. | 电解X与R形成化合物的溶液可获得X的单质 |
5.硼在化合物中一般显正价.可用下述方法合成储氢材料氨硼烷:LiBH4+NH4Cl=NH3BH3+LiCl+H2↑.NH3BH3在催化剂存在时可以与水发生催化脱氢反应:NH3BH3+2H2O$\frac{\underline{\;催化剂\;}}{\;}$NH4BO2+3H2↑.下列有关说法正确的是( )
| A. | NH3BH3中H元素均为+1价 | |
| B. | 合成反应中每生成1 mol NH3BH3会转移2 mol e- | |
| C. | 两个反应中,H2均既是氧化产物,又是还原产物 | |
| D. | 0.1 mol NH3BH3发生上述催化脱氢反应,一定生成6.72 L H2 |
20.“电池新贵”铝电池是用石墨作为正极材料,用有机阳离子、Al2Cl7-和AlCl4-组成的离子液体作为电解液的二次电池,电池充电快、容量高、成本低、也很安全.已知该电池工作的过程中不产生其他离子且有机阳离子不参与电极反应,则下列说法正确的是( )
| A. | 电池工作时,有机阳离子通过外电路移向石墨电极 | |
| B. | 若用该电池给钢制品表面电镀Al,则钢制品应该接电池的正极 | |
| C. | 电池充电时,阴极的电极反应式为4Al2Cl7-+3e-=Al+7AlCl4- | |
| D. | 若改用NaOH溶液作电解液,则Al电极的反应式为Al-3e-+3OH-=Al(OH)3↓ |
 )是一种名贵的香料,又是合成VE、VA、紫罗兰酮、胡萝卜素等的中间体.合成芳樟醇的一种方法如下:
)是一种名贵的香料,又是合成VE、VA、紫罗兰酮、胡萝卜素等的中间体.合成芳樟醇的一种方法如下: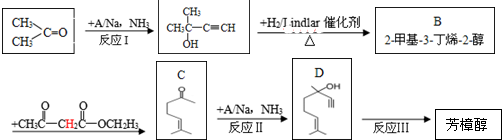
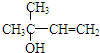 ,C分子中的官能团名称为羰基、碳碳双键,已知反应I和反应Ⅱ的原子利用率100%,则A的结构简式为HC≡CH.
,C分子中的官能团名称为羰基、碳碳双键,已知反应I和反应Ⅱ的原子利用率100%,则A的结构简式为HC≡CH.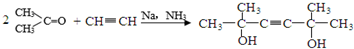 .
. ,写出柠檬醛的另一种同分异构体的结构简式(不改变分子中原子的连接方式)
,写出柠檬醛的另一种同分异构体的结构简式(不改变分子中原子的连接方式)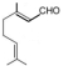 ;芳樟醇在H+作用下也可异构化为香叶醇(
;芳樟醇在H+作用下也可异构化为香叶醇(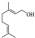 ).下列有关柠檬醛的下列说法正确的是BCD
).下列有关柠檬醛的下列说法正确的是BCD
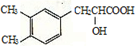 +NaHCO3
+NaHCO3
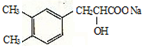 +CO2↑+H2O.
+CO2↑+H2O.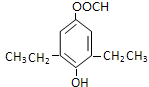 或
或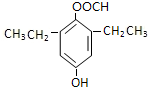 .
.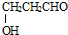 ,请写出以
,请写出以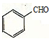 、CH3CH2OH为原料合成
、CH3CH2OH为原料合成 的路线流程图(无机试剂可任选).合成路线流程图如下:
的路线流程图(无机试剂可任选).合成路线流程图如下: