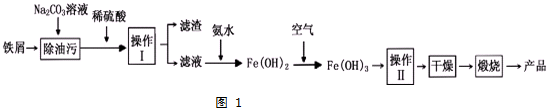
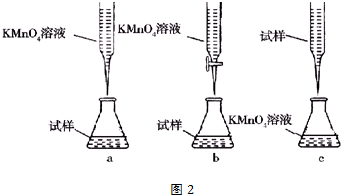
题目内容
17.X和Y均为短周期元素,已知aXn-比bYm+多两个电子层,下列说法正确的是( )| A. | b<2 | B. | X只能位于第三周期 | ||
| C. | a+n-b+m=10或16 | D. | Y不可能位于第二周期 |
分析 X和Y均为短周期元素,已知aXn-比bYm+多两个电子层,X可能为二、三周期元素,Y可能为一、二周期元素,如X为第二周期元素,则Y只能为第一周期元素,则Y只能为H,X可能为N、O、F等,如Y为第二周期元素,可为Li、Be等元素,则X可能为S、Cl等元素,以此解答该题.
解答 解:X和Y均为短周期元素,已知aXn-比bYm+多两个电子层,X可能为二、三周期元素,Y可能为一、二周期元素,如X为第二周期元素,则Y只能为第一周期元素,则Y只能为H,X可能为N、O、F等,如Y为第二周期元素,可为Li、Be等元素,则X可能为S、Cl等元素,
A.由以上分析可知Y可能为H、Li、Be等元素,如为Li、Be等元素,则b>2,故A错误;
B.X可能为二、三周期元素,如Y为第一周期元素,则X可为第二周期元素,Y为第二周期元素,则X为第三周期元素,故B错误;
C.aXn-比bYm+多两个电子层,如Y为第一周期元素,则X为第二周期元素,a+n-b+m=10,如Y为第二周期元素,则X为第三周期元素,a+n-b+m=18-2=16,故C正确;
D.由以上分析可知Y可为Li、Be等第二周期元素,故D错误.
故选:C.
点评 本题考查原子结构与元素的性质,为高考常见题型,侧重于学生的分析能力的考查,注意把握原子结构与元素在周期表中的位置的关系,题目难度中等.

练习册系列答案
相关题目
8.已知W、X、Y、Z、R是短周期中原子序数依次增大的5种主族元素,其中W、Z同族,且原子序数相差8,元素X在同周期的主族元素中原子半径最大,Y是地壳中含量最多的金属元素.下列说法中正确的是( )
| A. | 气态氢化物稳定性:R>Z>W | |
| B. | 原子半径:R<W<Y<Z<X | |
| C. | X分别与W、R形成的化合物的化学键类型不一定相同 | |
| D. | 电解X与R形成化合物的溶液可获得X的单质 |
5.硼在化合物中一般显正价.可用下述方法合成储氢材料氨硼烷:LiBH4+NH4Cl=NH3BH3+LiCl+H2↑.NH3BH3在催化剂存在时可以与水发生催化脱氢反应:NH3BH3+2H2O$\frac{\underline{\;催化剂\;}}{\;}$NH4BO2+3H2↑.下列有关说法正确的是( )
| A. | NH3BH3中H元素均为+1价 | |
| B. | 合成反应中每生成1 mol NH3BH3会转移2 mol e- | |
| C. | 两个反应中,H2均既是氧化产物,又是还原产物 | |
| D. | 0.1 mol NH3BH3发生上述催化脱氢反应,一定生成6.72 L H2 |
6.下列关于化学平衡的说法中,正确的是( )
| A. | 当达到化学平衡时,反应物已完全转化为生成物 | |
| B. | 化学平衡是一定条件下的平衡,当条件改变时,平衡可能会遭到破坏 | |
| C. | 当达到化学平衡时,反应混合物中各成分的浓度相等 | |
| D. | 当达到化学平衡时,正逆反应均已停止 |
4.下列有关说法不正确的是( )
| A. | 2014年德美科学家因开发超分辨率荧光显微镜获诺贝尔化学奖,使光学显微镜分辨率步入了纳米时代.利用此类光学显微镜可以观察活细胞内蛋白质等大分子 | |
| B. | 熟石膏与水混合成糊状后会很快凝固,转化为坚硬的生石膏,可用它制作石膏绷带 | |
| C. | 蚕丝、过氧化氢酶、核酸充分水解后均可得到α氨基酸 | |
| D. | 氢键在形成蛋白质二级结构和DNA双螺旋结构中起关键作用 |

 .
. .
. )的合成路线:
)的合成路线: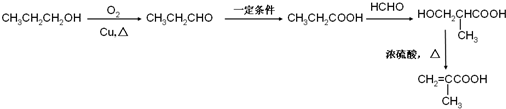 .
.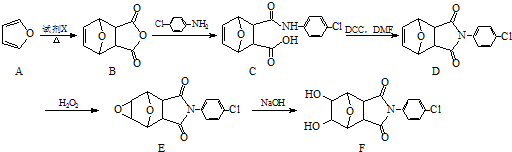
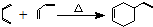 ;②
;②
 )、羧基和醚键.(填名称)
)、羧基和醚键.(填名称)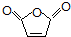 ;D→E的反应类型是氧化反应.
;D→E的反应类型是氧化反应.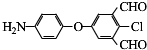 等.
等. )的合成路线流程图(无机试剂可任选)).合成路线流程图示例如下:
)的合成路线流程图(无机试剂可任选)).合成路线流程图示例如下: