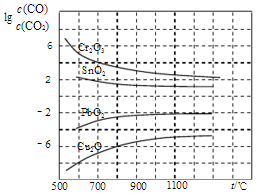
题目内容
11.下列实验操作中,正确的是( )| A. | 利用过滤分离溶液和胶体 | |
| B. | 用渗析法可以除去溶液中的胶体粒子 | |
| C. | 向氢氧化钠溶液中边滴加饱和FeCl3溶液边振荡制备Fe(OH)3胶体 | |
| D. | 向Fe(OH)3胶体中加入足量稀盐酸后,依然有丁达尔效应 |
分析 A.溶液和胶体都能透过滤纸;
B.溶液能透过半透膜,胶体不能透过半透膜;
C.制取氢氧化铁胶体方法:向沸水中滴入几滴饱和氯化铁溶液加热至液体呈红褐色为止;
D.胶体遇电解质溶液发生聚沉现象,过量稀盐酸能和氢氧化铁反应生成氯化铁,溶液没有丁达尔效应.
解答 解:A.溶液和胶体都能透过滤纸,所以不能用过滤方法分离溶液和胶体,应该用渗析方法分离溶液和胶体,故A错误;
B.溶液能透过半透膜,胶体不能透过半透膜,所以可以用渗析法分离溶液和胶体,故B正确;
C.制取氢氧化铁胶体方法:向沸水中滴入几滴饱和氯化铁溶液加热至液体呈红褐色为止,氢氧化钠和氯化铁反应生成氢氧化铁沉淀,故C错误;
D.胶体遇电解质溶液发生聚沉现象,过量稀盐酸能和氢氧化铁反应生成氯化铁,最后得到的是溶液,溶液没有丁达尔效应,所以不再产生丁达尔效应,故D错误;
故选B.
点评 本题考查化学实验方案评价,为高频考点,涉及物质分离和提纯、物质制备、胶体性质,明确实验原理、物质性质差异性是解本题关键,注意:胶体能透过滤纸,但不能透过半透膜,易错选项是C.

练习册系列答案
 名题金卷系列答案
名题金卷系列答案 优加精卷系列答案
优加精卷系列答案
相关题目
2. 汽车尾气是造成雾霾天气的原因之一.
汽车尾气是造成雾霾天气的原因之一.
(1)汽车尾气中含有CO、NO2等有毒气体对汽车加装尾气净化装置可使有毒气体相互反应转化为无毒气体. 写出该反应的热化学方程式4CO(g)+2NO2(g)=4CO2(g)+N2(g)△=-1200.0kJ/mol.
N2(g)+2O2(g)═2NO2(g)△H=+68.0kJ•mol-1;
2C(s)+O2(g)═2CO(g)△H=-221.0kJ•mol-1;
C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
(2)汽车尾气中含有CO和H2O(g)在一定条件下可以发生反应
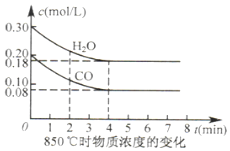
CO(g)+H2O(g)?CO2(g)+H2(g)△H<0.850℃在体积为10L反应器中通入一定量的CO和H2O(g)发生上述反应CO和H2O(g)的浓度变化如图所示则0-4min是平均反应速率v(H2O)=0.03mol•L-1•min-1此时K=1.
850℃在甲、乙、丙三个1L的恒容密闭容器中,起始时按照表进行投料,达到平衡状态.平衡时甲容器中CO的转化率是50%.比较下列容器中CO的转化率甲<乙(填“大于”、“<”或“等于”).
 汽车尾气是造成雾霾天气的原因之一.
汽车尾气是造成雾霾天气的原因之一.(1)汽车尾气中含有CO、NO2等有毒气体对汽车加装尾气净化装置可使有毒气体相互反应转化为无毒气体. 写出该反应的热化学方程式4CO(g)+2NO2(g)=4CO2(g)+N2(g)△=-1200.0kJ/mol.
N2(g)+2O2(g)═2NO2(g)△H=+68.0kJ•mol-1;
2C(s)+O2(g)═2CO(g)△H=-221.0kJ•mol-1;
C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
(2)汽车尾气中含有CO和H2O(g)在一定条件下可以发生反应
CO(g)+H2O(g)?CO2(g)+H2(g)△H<0.850℃在体积为10L反应器中通入一定量的CO和H2O(g)发生上述反应CO和H2O(g)的浓度变化如图所示则0-4min是平均反应速率v(H2O)=0.03mol•L-1•min-1此时K=1.
| 起始物质的量 | 甲 | 乙 | 丙 |
| n(H2O)/mol | 0.10 | 0.20 | 0.20 |
| n(CO)/mol | 0.10 | 0.10 | 0.20 |
6.室温下,下列各离子组在指定的溶液中一定能够大量共存的是( )
| A. | 在无色的溶液中:K+、Na+、MnO4-、SO42- | |
| B. | 在pH=11的溶液中:CO32-、Na+、NO3-、SO42- | |
| C. | 水电离出的c(H+)=10-12mol•L?1的溶液中:Cl-、HCO3-、NO3-、NH4+ | |
| D. | 在酸性溶液中:Na+、NH4+、SO42-、S2O32- |
16.下列表述正确的是( )
| A. | 醛基的结构简式-COH | B. | 聚丙烯的结构简式  | ||
| C. | 四氯化碳分子的电子式  | D. | 丙烷分子的球棍模型  |
3.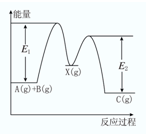 反应A(g)+B(g)→C(g)△H,分两步进行:①A(g)+B(g)→X(g)△H1,②X(g)→C(g)△H2,反应过程中能量变化如图所示,E1表示A(g)+B(g)→X(g)的活化能,下列说法正确的是( )
反应A(g)+B(g)→C(g)△H,分两步进行:①A(g)+B(g)→X(g)△H1,②X(g)→C(g)△H2,反应过程中能量变化如图所示,E1表示A(g)+B(g)→X(g)的活化能,下列说法正确的是( )
 反应A(g)+B(g)→C(g)△H,分两步进行:①A(g)+B(g)→X(g)△H1,②X(g)→C(g)△H2,反应过程中能量变化如图所示,E1表示A(g)+B(g)→X(g)的活化能,下列说法正确的是( )
反应A(g)+B(g)→C(g)△H,分两步进行:①A(g)+B(g)→X(g)△H1,②X(g)→C(g)△H2,反应过程中能量变化如图所示,E1表示A(g)+B(g)→X(g)的活化能,下列说法正确的是( )| A. | △H=E1-E2 | B. | E1是反应①的活化能 | ||
| C. | X是反应A(g)+B(g)→C(g)的催化剂 | D. | △H2>0 |
20.下列溶液中的Cl-浓度与100mL 1mol•L-1 MgCl2溶液中的Cl-浓度相等的是( )
| A. | 50mL 1 mol•L-1 NaCl溶液 | B. | 100mL2 mol•L-1 AlCl3溶液 | ||
| C. | 100mL1 mol•L-1 NH4Cl溶液 | D. | 150mL2 mol•L-1 KCl溶液 |
1.下列反应的离子方程式中,正确的是( )
| A. | 铁跟稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 碳酸钙溶液跟盐酸反应:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 盐酸跟氢氧化镁溶液反应:H++OH-═H2O | |
| D. | 氢氧化钡跟硫酸铜反应:Ba2++SO42-═BaSO4↓ |
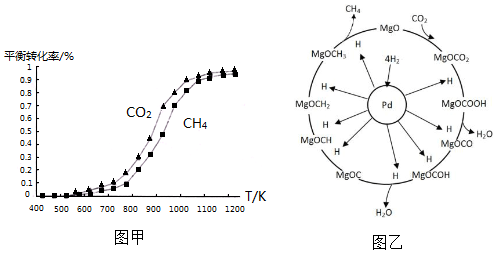 ①同温度下CO2的平衡转化率大于(填“大于”或“小于”)CH4的平衡转化率,其原因是CO2发生了其他副反应.
①同温度下CO2的平衡转化率大于(填“大于”或“小于”)CH4的平衡转化率,其原因是CO2发生了其他副反应. CH4+2H2O.
CH4+2H2O.