题目内容
1.氢气是未来最理想的能源,科学家已研制出利用太阳能产生激光,并在二氧化钛(TiO2)表面作用使海水分解得到氢气的新技术:2H2O$\frac{\underline{\;激光\;}}{TiO_{2}}$2H2↑+O2↑.试回答下列问题:(1)分解海水的反应属于吸热反应(填“放热”或“吸热”).
(2)燃料电池使用气体燃料和氧气直接反应产生电能,是一种很有前途的能源利用方式.某种氢氧燃料电池是用20%KOH溶液作电解质,正极反应为:O2+4e-+2H2O═4OH-,则电池供电的负极反应为:2H2+4OH--4e-═4H2O(或H2+2OH--2e-═2H2O).供电过程中,溶液的PH减小(填“增大”或“减小”)
(3)科学家最近研究出一种环保,安全的储氢方法,其原理可表示为:NaHCO3+H2 $?_{释氢}^{储氢}$HCOONa+H2O下列有关说法正确的是C.
A.储氢、释氢过程均无能量变化
B.储氢过程中,NaHCO3被氧化
C.NaHCO3具有离子键和共价键
D.释氢过程中,每消耗0.1mol H2O放出2.24L的H2.
分析 (1)水在催化剂和激光条件下分解,吸收能量;
(2)氢氧燃料电池是将化学能转变为电能的装置,工作时,通入氢气的一极为电池的负极,发生氧化反应,通入氧气的一极为电池的正极,发生还原反应;
(3)A.储氢释氢是化学变化,化学变化中一定伴随能量变化;
B.储氢过程中C元素的化合价由+4降低为+2;
C.NaHCO3晶体中HCO3-中含有共价键,HCOONa晶体中HCOO-中含有共价键;
D.气体体积与温度和压强有关.
解答 解:(1)水在催化剂和激光条件下分解,吸收能量,为吸热反应,故答案为:吸热;
(2)负极通入氢气,氢气被氧化,电极方程式为2H2+4OH--4e-═4H2O(或H2+2OH--2e-═2H2O),总反应为2H2+O2═2H2O,电解质溶液体积增大,氢氧化钠浓度减小,则pH减小,
故答案为:2H2+4OH--4e-═4H2O(或H2+2OH--2e-═2H2O);减小;
(3)A.储氢、释氢过程都是化学变化,伴随之化学键的断裂和形成,则化学变化中一定伴随能量变化,故A错误;
B.储氢过程中C元素的化合价由+4降低为+2,NaHCO3被还原,故B错误;
C.NaHCO3晶体是离子晶体,由Na+与HCO3-构成,HCO3-中含有共价键,HCOONa晶体是离子晶体,由Na+与HCOO-构成,HCOO-中含有共价键,故C正确;
D.释氢过程中,每消耗0.1molH2O放出0.1mol的H2,只有在标准状况下0.1mol的H2为2.24L,该题未指明在标准状况下,所以0.1mol的H2不一定为2.24L,故D错误.
故答案为:C.
点评 本题以储氢方法为载体考查了氧化还原反应、化学反应中能量变化、化学键、气体摩尔体积的应用条件等,为高频考点,题目综合性较强,平时注意基础知识的全面掌握,题目难度不大.

| A. | 为了使火腿肠颜色更鲜红,可多加一些亚硝酸钠 | |
| B. | 为了使婴儿对食品有浓厚兴趣,我们可以在婴儿食品中加少量着色剂 | |
| C. | 食盐加碘是防止人体缺碘而加的营养强化剂,能预防地方性甲状腺肿 | |
| D. | 味精能增加食品的鲜味,促进食欲,炒菜时应该多放一点 |
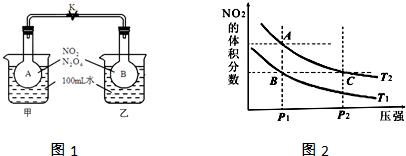
(1)C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2的产率的是AD;(填序号)
A.升高温度 B.增加碳的用量 C.加入催化剂 D.用CO吸收剂除去CO
(2)又知,C(s)+CO2(g)?2CO(g)△H=+172.5kJ•mol-1,则CO(g)+H2O(g)?CO2(g)+H2(g)的△H=-41.2kJ/mol;
(3)在一定温度下,将CO(g)和H2O(g)各0.16mol分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下数据:
| t/min | 2 | 4 | 7 | 9 |
| n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
②该温度下此反应的平衡常数K=0.36;
③其他条件不变,再充入0.1mol CO和0.1mol H2O(g),平衡时CO的体积分数不变(填“增大”、“减小”、“不变”).
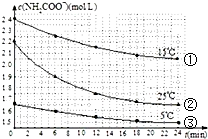 已知氨基甲酸铵发生的水解反应为:NH2COONH4+2H2O?NH4HCO3+NH3•H2O,某研究小组得到c(NH2COO-)随时间变化曲线如图所示.下列有关说法一定正确的是( )
已知氨基甲酸铵发生的水解反应为:NH2COONH4+2H2O?NH4HCO3+NH3•H2O,某研究小组得到c(NH2COO-)随时间变化曲线如图所示.下列有关说法一定正确的是( )| A. | 对比①与③,可知浓度越大水解速率越快 | |
| B. | 对比①与②,可知温度越高水解速率越快 | |
| C. | 加水稀释,平衡向正反应方向移动,K值增大 | |
| D. | 氨基甲酸铵在碱性条件下比在酸性条件下水解程度大 |
| 化学反应 | 平衡 常数 | 温度/℃ | ||
| 500 | 700 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.34 | 0.15 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g) | K2 | 1.0 | 1.70 | 2.52 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | |||
(1)反应②是吸热(填“吸热”或“放热”)反应.
(2)据反应①与②可推导出K1、K2与K3之间的关系,则K3=K1•K2(用K1、K2表示).
(3)500℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol•L-1)分别为0.8、0.1、0.3、0.15,则此时v正>v逆(填“>”、“=”或“<”).
(4)反应①按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图1所示.
下列说法正确的是C(填序号).
A.温度:T1>T2>T3
B.正反应速率:v(a)>v(c),v(b)>v(d)
C.平衡常数:K(a)>K(c),K(b)=K(d)
(5)新型高效的甲醇燃料电池采用铂为电极材料,两电极上分别通入CH3OH和O2.
某研究小组将两个甲醇燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图2所示.回答下列问题:
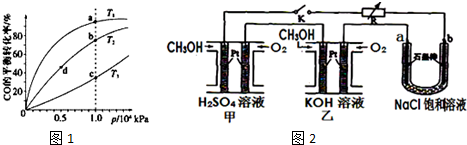
乙燃料电池的负极反应式为2CH3OH-12e-+16OH-=2CO32-+12H2O.
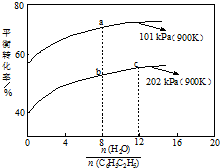 苯乙烯(C8H8)是生产各种塑料的重要单体,其制备原理是:
苯乙烯(C8H8)是生产各种塑料的重要单体,其制备原理是:C8H10 (g)(乙苯)?C8H8 (g)(苯乙烯)+H2(g),
实际生产中常以高温水蒸气作为反应体系的稀释剂(水蒸气不参加反应),如图为乙苯的平衡转化率与水蒸气的用量、体系总压强的关系.下列说法正确的是( )
| A. | a点转化率为75%,若起始向1 L恒容容器中充入1 mol 乙苯,则平衡常数为2.25 | |
| B. | b点转化率为50%,则混合气体中苯乙烯的体积分数为$\frac{1}{19}$ | |
| C. | 恒容时加入稀释剂能减小C8H10 (g)平衡转化率 | |
| D. | b点和c点温度和压强相同,所以反应速率也相等 |
| A. | 利用过滤分离溶液和胶体 | |
| B. | 用渗析法可以除去溶液中的胶体粒子 | |
| C. | 向氢氧化钠溶液中边滴加饱和FeCl3溶液边振荡制备Fe(OH)3胶体 | |
| D. | 向Fe(OH)3胶体中加入足量稀盐酸后,依然有丁达尔效应 |
 .
.