题目内容
6.室温下,下列各离子组在指定的溶液中一定能够大量共存的是( )| A. | 在无色的溶液中:K+、Na+、MnO4-、SO42- | |
| B. | 在pH=11的溶液中:CO32-、Na+、NO3-、SO42- | |
| C. | 水电离出的c(H+)=10-12mol•L?1的溶液中:Cl-、HCO3-、NO3-、NH4+ | |
| D. | 在酸性溶液中:Na+、NH4+、SO42-、S2O32- |
分析 A.MnO4-为紫色;
B.pH=11的溶液,显碱性;
C.水电离出的c(H+)=10-12mol•L?1的溶液,为酸或碱溶液;
D.酸性溶液含大量的氢离子.
解答 解:A.MnO4-为紫色;与无色不符,故A不选;
B.pH=11的溶液,显碱性,该组离子之间不反应,可大量共存,故B选;
C.水电离出的c(H+)=10-12mol•L?1的溶液,为酸或碱溶液,酸溶液中不能大量存在HCO3-,碱溶液中不能大量存在HCO3-、NH4+,故C不选;
D.酸性溶液含大量的氢离子,与S2O32-发生氧化还原反应不能共存,故D不选;
故选B.
点评 本题考查离子的共存,为高频考点,把握常见离子之间的反应为解答关键,侧重分析与应用能力的考查,注意复分解反应、氧化还原反应的判断,题目难度不大.

练习册系列答案
相关题目
16.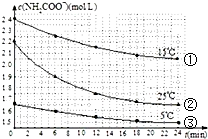 已知氨基甲酸铵发生的水解反应为:NH2COONH4+2H2O?NH4HCO3+NH3•H2O,某研究小组得到c(NH2COO-)随时间变化曲线如图所示.下列有关说法一定正确的是( )
已知氨基甲酸铵发生的水解反应为:NH2COONH4+2H2O?NH4HCO3+NH3•H2O,某研究小组得到c(NH2COO-)随时间变化曲线如图所示.下列有关说法一定正确的是( )
 已知氨基甲酸铵发生的水解反应为:NH2COONH4+2H2O?NH4HCO3+NH3•H2O,某研究小组得到c(NH2COO-)随时间变化曲线如图所示.下列有关说法一定正确的是( )
已知氨基甲酸铵发生的水解反应为:NH2COONH4+2H2O?NH4HCO3+NH3•H2O,某研究小组得到c(NH2COO-)随时间变化曲线如图所示.下列有关说法一定正确的是( )| A. | 对比①与③,可知浓度越大水解速率越快 | |
| B. | 对比①与②,可知温度越高水解速率越快 | |
| C. | 加水稀释,平衡向正反应方向移动,K值增大 | |
| D. | 氨基甲酸铵在碱性条件下比在酸性条件下水解程度大 |
14.我国稀土资源丰富,下列有关稀土元素${\;}_{62}^{144}Sm$与${\;}_{62}^{150}Sm$的说法正确的是( )
| A. | ${\;}_{62}^{144}Sm$与${\;}_{62}^{150}Sm$互为同位素 | |
| B. | ${\;}_{62}^{144}Sm$与${\;}_{62}^{150}Sm$的质量数相同 | |
| C. | ${\;}_{62}^{144}Sm$与${\;}_{62}^{150}Sm$是同一种核素 | |
| D. | ${\;}_{62}^{144}Sm$与${\;}_{62}^{150}Sm$的核外电子数和中子数均为62 |
1.下列反应的离子方程式正确的是( )
| A. | 氯化铝溶液加入过量氨水:Al3++3OH-═Al(OH)3↓ | |
| B. | 稀盐酸滴在石灰石上:CO32-+2H+═CO2↑+H2O | |
| C. | 碳酸氢钠和稀硫酸反应:HCO3-+H+═CO2↑+H2O | |
| D. | 氯气与水反应:Cl2+H2O═2H++Cl-+ClO- |
11.下列实验操作中,正确的是( )
| A. | 利用过滤分离溶液和胶体 | |
| B. | 用渗析法可以除去溶液中的胶体粒子 | |
| C. | 向氢氧化钠溶液中边滴加饱和FeCl3溶液边振荡制备Fe(OH)3胶体 | |
| D. | 向Fe(OH)3胶体中加入足量稀盐酸后,依然有丁达尔效应 |
18.关于苯及苯的同系物的说法,不正确的是( )
| A. | 利用甲苯的硝化反应可以制得TNT炸药 | |
| B. | 苯与甲苯互为同系物,可以用KMnO4酸性溶液进行鉴别 | |
| C. | 苯和溴水振荡后,由于发生化学反应而使溴水的水层颜色变浅 | |
| D. | 煤焦油中含有苯和甲苯,用蒸馏的方法把它们分离出来 |
15.大米属于( )
| A. | 中性食品 | B. | 碱性食品 | C. | 弱碱性食品 | D. | 酸性食品 |
16.合成氨的热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol.现将1molN2(g)、3molH2(g)充入一容积为2L的密闭容器中,在500℃下进行反应,10min时达到平衡,NH3的体积分数为φ,下列说法中正确的是( )
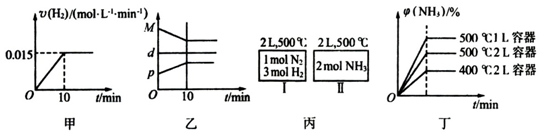

| A. | 若达到平衡时,测得体系放出9.24kJ热量,则H2反应速率变化曲线如图甲所示 | |
| B. | 反应过程中,混合气体平均相对分子质量为M,混合气体密度为d,混合气体压强为p,三者关系如图乙 | |
| C. | 如图丙所示,容器I和II达到平衡时,NH3的体积分数为φ,则容器I放出热量与容器II吸收热量之和为92.4kJ | |
| D. | 若起始加入物料为1 mol N2,3 mol H2,在不同条件下达到平衡时,NH3的体积分数变化如图丁所示 |
 ,W与R形成的化合物的化学式为Na3N.它们的晶体属于离子晶体.
,W与R形成的化合物的化学式为Na3N.它们的晶体属于离子晶体.