题目内容
3. 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一.
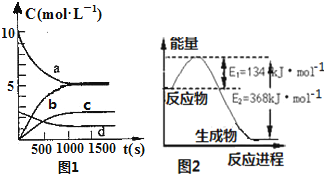
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一.(1)一定温度下,在体积为2L的恒容密闭容器中充入20molNO2和5molO2发生如下反应:4NO2(g)+O2(g)?2N2O5(g);已知体系中n(NO2)随时间变化如图1:
| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
②反应达到平衡后,NO2的转化率为,若要增大NO2的转化率,可采取的措施有BC.
A.再充入NO2 B.再充入4molNO2和1molO2 C.降低温度 D.充入氦气
③图1中表示N2O5的浓度的变化曲线是c;
(2)图2是1molNO2气体和1molCO气体反应生成CO2气体和NO气体过程中能量变化示意图;又已知:
2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-760.3kJ•mol-1,则反应:
N2(g)+2NO2(g)?4NO(g) 的△H=+292.3kJ•mol-1.
分析 (1)①化学平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比值;温度低,化学平衡常数大,则正反应放热;
②NO2转化率为已转化的NO2物质的量与起始物质的量的百分比;增大NO2的转化率,促进反应的正向移动即可;
③N2O5为生成物且反应为可逆反应,反应不可能进行到底,以此判断表示N2O5的浓度的变化曲线;
(2)根据能量变化图,反应热等于=正反应的活化能减去逆反应的活化能,结合热化学方程式的书写规则书写;利用写出的热化学方程式,结合给出的热化学方程式,利用盖斯定律解答该题.
解答 解:(1)①化学平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比值,即K=$\frac{c{\;}^{2}(N{\;}_{2}O{\;}_{5})}{{c}^{4}(NO{\;}_{2})•c(O{\;}_{2})}$;温度低,化学平衡常数大,则正反应放热,
故答案为:$\frac{c{\;}^{2}(N{\;}_{2}O{\;}_{5})}{{c}^{4}(NO{\;}_{2})•c(O{\;}_{2})}$;放热;
②转化的NO2的物质的量为20mol-10.08mol=9.92mol,转化率为$\frac{9.92mol}{20mol}$=49.6%;
A、再充入NO2,转化的物质的量增大,但是起始的物质的量增大较多,转化率降低,故A错误;
B、加入气体比例与原平衡NO2的转化率相同,由于加入气体后,体系压强增大,NO2的转化率增大,故B正确;
C、该反应为放热反应,降低温度,化学平衡向右移动,故C正确;
D、反应气体浓度不变,化学平衡不移动,故D错误;
故选BC;
③N2O5为生成物浓度增大,反应为可逆反应,不可能进行到底,即N2O5的浓度不可能达到5mol/L,故选c;
(2)该反应的焓变△H=E1-E2=134KJ/mol-368KJ/mol=-234KJ/mol,所以热化学方程式为:①NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ•mol-1;②2NO(g)+2CO(g)?N2(g)+2CO2(g),△H=-760.3kJ•mol-1,反应①×2-②,可得到:N2 (g)+2NO2 (g)?4NO(g)△H=+292.3kJ•mol-1,
故答案为:+292.3kJ•mol-1.
点评 本题考查化学平衡影响因素、化学平衡的计算,题目计算量较大,难度较大,关键是构建平衡建立的等效途径,中注意从正、逆不同方向建立的等效平衡转化率、反应热的关系.

 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案能表示该反应已达平衡状态的是( )
| A. | 2V正(B)=V逆(D) | |
| B. | 混合气体的密度保持不变 | |
| C. | 混合气体中B、C、D的浓度之比为2:2:1 | |
| D. | 混合气体的压强不随时间变化而变化 |
| A. | 4 mol A+2 mol B | |
| B. | 1 mol B+3 mol C+1 mol D | |
| C. | 3 mol C+2 mol D | |
| D. | 1 mol A+0.5 mol B+1.5 mol C+0.5 mol D |
| 时间(min) 物质的量(mol) | 0 | 10 | 20 | 30 | 40 | 50 |
| B | 2.00 | 1.36 | 1.00 | 1.00 | 1.20 | 1.20 |
| D | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
| E | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
(2)30min后,只改变某一条件,反应重新达到平衡,根据表中的数据判断改变的条件可能是ae(填字母编号).
a.通入一定量的B b.加入一定量的固体A c.适当缩小容器的体积
d.升高反应体系温度 e.同时加入0.2molB、0.1molD、0.1molE
(3)对于该反应,用各物质表示的反应速率与时间的关系示意曲线为图1中的④(填序号).
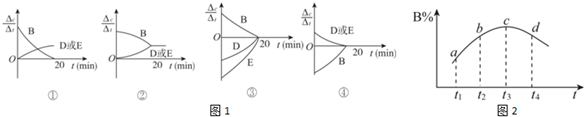
(4)维持容器的体积和温度T1不变,当向该容器中加入1.60 mol B、0.20 mol D、0.20 mol E和nmolA,达到平衡后,与表格中20分钟时各物质的浓度完全相同时,则投入固体A的物质的量n的取值范围是>0.3.
(5)维持容器的体积和温度T1不变,各物质的起始物质的量为n(A)=1.0 mol,n(B)=3.0 mol,n(D)=a mol,达到平衡后,n(E)=0.50 mol,则a=1.5.
(6)若该密闭容器绝热,实验测得B的转化率B%随时间变化的示意图如图2所示.由图可知,Q小于0(填“大于”或“小于”),c点v正等于v逆(填“大于”“小于”或“等于”).
(1)工业上可用纯碱、焦炭、氨气在高温下反应可以制取NaCN,写出反应的化学方程式Na2CO3+C+2NH3=2NaCN+3H2O.
(2)工业利用NaCN制备蓝色染料的流程如下:
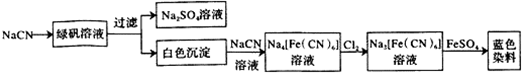
通入Cl2时发生反应的离子方程式为_2[Fe(CN)6]4-+Cl2=2[Fe(CN)6]3-+2Cl-_,该蓝色染料的化学式为Fe3[Fe(CN)6]2.
(3)现代采金技术先以NaCN溶液在自然环境中浸取粉碎的含金(Au)矿石,得到Na[Au(CN)2](二氰合金酸钠)溶液,再用锌还原Na[Au(CN)2]生成金.浸取过程的氧化剂是O2.
(4)上述方法的主要缺点是容易引起水体污染.天津“8.12“爆炸中扩散的CN-也造成了部分水体污染.某小组欲检测污水中CN-的浓度.
资料:碱性条件下发生离子反应:2CN-+5H2O2+2OH-=2CO32-+N2+6H2O
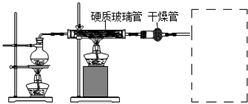
实验装置如图(其中加热、夹持装置省略).(不考虑污水中其它离子反应)
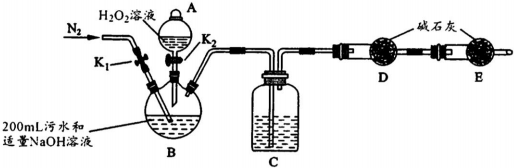
①加入药品之前的操作是检查装置气密性;B的名称是三颈瓶,C中试剂是浓H2S04.
②实验步骤如下:
| 步骤1 | 关闭K1,打开K2,滴入足量H2O2溶液,对B加热.充分反应后,停止加热. |
| 步骤2 | 冷却后,用注射器穿过B装置的胶塞注入稀H2S04溶液. |
| 步骤3 | 打开K1,通入N2. |
(5)常温下HCN的电离常数Ka=6.2×10-10,浓度均为0.5mol/L的NaCN和HCN的混合溶液显碱(填“酸”、“碱”或“中”)性,通过计算说明其原因Kh=$\frac{Kw}{Ka}$=$\frac{1{0}^{-14}}{6.2×1{0}^{-10}}$=1.6×10-5>6.2×10-10,即水解平衡常数大于电离平衡常数,所以溶液呈碱性.
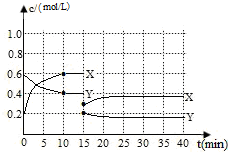 已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.现将一定量NO2和N2O4的混合气体通入体积为1L的恒温密闭容器中发生上述反应,反应物浓度随时间变化关系如下图所示.X与Y两条曲线中,Y表示N2O4浓度随时间的变化
已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.现将一定量NO2和N2O4的混合气体通入体积为1L的恒温密闭容器中发生上述反应,反应物浓度随时间变化关系如下图所示.X与Y两条曲线中,Y表示N2O4浓度随时间的变化