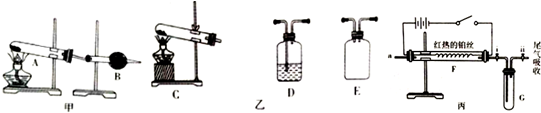
题目内容
1.根据要求回答下列问题:(1)硝酸钠、75%的酒精溶液、Fe(OH)3胶体、豆浆这些物质能与Ba(OH)2(固体)、CuSO4(固体)、CH3COOH(液态)归为一类的是硝酸钠.
(2)下列仪器:容量瓶、蒸馏烧瓶、漏斗、分液漏斗,其中不能用于物质分离的是容量瓶.
(3)相同物质的量的O2和O3的质量比2:3,分子个数比为1:1,所含氧原子的个数比为2:3
(4)下列各组物质的分离或提纯,应选用下述方法的哪一种?(填选项字母)
A.分液 B.过滤 C.萃取 D.蒸馏 E.蒸发结晶 F.高温分解
①分离CCl4和H2O:A;
②除去澄清石灰水中悬浮的CaCO3:B;
③除去CaO固体中少量的CaCO3固体:F;
④从碘水中提取碘:C;
⑤分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的液体混合物:D.
分析 (1)Ba(OH)2(固体)、CuSO4(固体)、CH3COOH(液态)均为电解质;
(2)容量瓶只能配制溶液;
(3)根据m=nM计算二者质量之比,由N=nNA可知,分子数目之比等于物质的量之比;氧气所含氧原子数目为氧气分子2倍,臭氧所含氧原子数目为臭氧分子的3倍;
(4)①CCl4和H2O分层;
②碳酸钙不溶于水;
③碳酸钙高温分解生成CaO;
④碘不易溶于水,易溶于有机溶剂;
⑤四氯化碳、甲苯互溶,但沸点不同.
解答 解:(1)Ba(OH)2(固体)、CuSO4(固体)、CH3COOH(液态)均为电解质,而硝酸钠属于电解质,75%的酒精溶液、Fe(OH)3胶体、豆浆均为混合物,
故答案为:硝酸钠;
(2)容量瓶只能配制溶液,蒸馏烧瓶用于蒸馏分离,漏斗用于过滤分离,分液漏斗用于分液分离,故答案为:容量瓶;
(3)根据m=nM可知,相同物质的量的O2和O3的质量之比=32g/mol:48g/mol=2:3,由N=nNA可知,分子数目之比等于物质的量之比=1:1;氧气所含氧原子数目为氧气分子2倍,臭氧所含氧原子数目为臭氧分子的3倍,故相同物质的量的O2和O3含有氧原子数目之比=1×2:1×3=2:3,
故答案为:2:3;1:1;2:3;
(4)①CCl4和H2O分层,则选择分液法分离,故答案为:A;
②碳酸钙不溶于水,则选择过滤法分离,故答案为:B;
③碳酸钙高温分解生成CaO,则选择加热法分离,故答案为:F;
④碘不易溶于水,易溶于有机溶剂,则选择萃取法,故答案为:C;
⑤四氯化碳、甲苯互溶,但沸点不同,则选择蒸馏法分离,故答案为:D.
点评 本题考查混合物的分离提纯,为高频考点,把握物质的分类、仪器的使用、物质的性质及混合物分离方法选择为解答的关键,侧重分析与应用能力的考查,题目难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案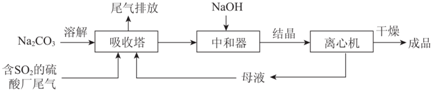
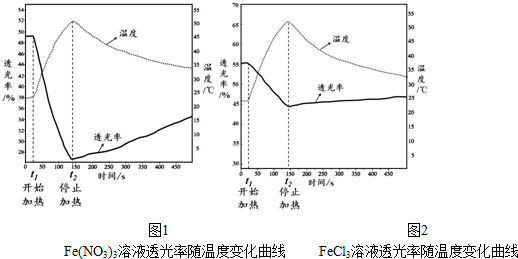
(1)举例说明向大气中排放SO2导致的环境问题:酸雨.
(2)如图为吸收塔中Na2CO3溶液与SO2反应过程中溶液组成变化.则初期反应(图中A点以前)的离子方程式是2CO32-+SO2+H2O=2HCO3-+SO32-.
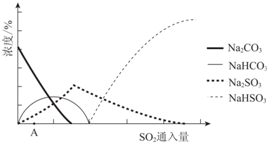
(3)中和器中发生的主要反应的化学方程式是NaHSO3+NaOH=Na2SO3+H2O.
| 资料显示: Ⅰ.Na2SO3在33℃时溶解度最大,将其饱和溶液加热至33℃以上时,由于溶解度降低会析出无水Na2SO3,冷却至33℃以下时析出Na2SO3•7H2O; Ⅱ.无水Na2SO3在空气中不易被氧化,Na2SO3•7H2O在空气中易被氧化. |
①请结合Na2SO3的溶解平衡解释NaOH过量的原因Na2SO3存在溶解平衡:Na2SO3(s)?2Na+ (aq)+SO32- (aq),NaOH过量使c(Na+)增大,上述平衡逆向移动.
②结晶时应选择的最佳操作是B(选填字母).
a.95~100℃加热蒸发,直至蒸干
B.维持95~100℃蒸发浓缩至有大量晶体析出
C.95~100℃加热浓缩,冷却至室温结晶
(5)为检验Na2SO3成品中是否含少量Na2SO4,需选用的试剂是稀盐酸、BaCl2溶液.
(6)KIO3滴定法可测定成品中Na2SO3的含量:室温下将0.1260g 成品溶于水并加入淀粉做指示剂,再用酸性KIO3标准溶液(x mol/L)进行滴定至溶液恰好由无色变为蓝色,消耗KIO3标准溶液体积为y mL.
①滴定终点前反应的离子方程式是:□IO3-+□SO32-=□3SO42-+□1I-(将方程式补充完整)
②成品中Na2SO3(M=126g/mol)的质量分数是3xy×100%.
| A. | 100 mL 2 mol/L的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变 | |
| B. | 用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快产生氢气的速率 | |
| C. | 汽车尾气中的CO和NO可以缓慢反应生成N2和CO2,加入催化剂,不影响CO的转化率 | |
| D. | 二氧化硫的催化氧化是一个放热反应,升高温度,平衡逆向移动,正反应速率减慢 |
(1)浓盐酸的物质的量浓度为12.5mol.l-1.
(2)配制 240mL 0.1mol•L-1 的盐酸
| 应量取浓盐酸体积/mL | 应选用容量瓶的规格/mL |
A.用30mL水洗涤烧杯内壁和玻璃棒2〜3次,洗涤液均注入容量瓶,振荡
B.用量筒淮确量取所需的浓盐酸的体积,倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1〜2cm处
(4)若实验中遇到下列情况,对盐酸溶液的物质的量浓度有何影响(填“偏高”、“偏低”或“不变”)?
①用于稀释盐酸的烧杯未洗涤,偏低.
②容量瓶中原有少量蒸馏水,不变.
③定容时观察液面俯视,偏高.
(5)若实验过程中出现如下情况如何处理?
①定容时加蒸馏水时超过了刻度重新配置.
②向容量瓶中转移溶液时有滚液不慎有溶液溅出重新配置.
③定容摇勻后发现液面下降无需再配.
| A. | 4 mol A+2 mol B | |
| B. | 1 mol B+3 mol C+1 mol D | |
| C. | 3 mol C+2 mol D | |
| D. | 1 mol A+0.5 mol B+1.5 mol C+0.5 mol D |
(1)请帮助他们完成以下实验报告:
实验目的:探究铁及其化合物的氧化性和还原性
试剂:铁粉、FeCl3溶液、FeCl2溶液、氯水、锌片、碘化钾、淀粉溶液
实验记录:
| 序号 | 实验内容 | 实验现象 | 离子方程式 | 实验结论 |
| ① | 在FeCl2溶液中滴入适量氯水 | 溶液由浅绿色变为黄色 | 2Fe2++Cl2=2Fe3++2Cl- | Fe2+具有还原性 |
| ② | 在FeCl2溶液中加入锌片 | (不写) | Zn+Fe2+=Zn2++Fe | Fe2+具有氧化性 |
| ③ | 在FeCl3溶液中加入足量铁粉 | 溶液由黄色变为浅绿色 | Fe+2Fe3+=3Fe2+ | Fe3+具有氧化性 |
| ④ | 在FeCl3溶液中滴入适量KI溶液和淀粉溶液 | 变蓝色 | 2Fe3++2I-=2Fe2++I2 | Fe3+具有氧化性 |
(2)亚铁盐在溶液中易被氧化,而实验中需要纯净的亚铁盐溶液.那么保存亚铁盐溶液时如何防止亚铁盐被氧化加铁粉.
(3)检验某铁盐溶液中是否含有亚铁盐的方法是取少量溶液于试管中滴加1滴酸性KMnO4溶液,若紫色褪去,则有Fe2+.
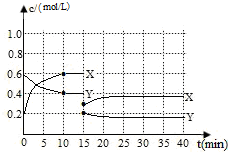 已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.现将一定量NO2和N2O4的混合气体通入体积为1L的恒温密闭容器中发生上述反应,反应物浓度随时间变化关系如下图所示.X与Y两条曲线中,Y表示N2O4浓度随时间的变化
已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.现将一定量NO2和N2O4的混合气体通入体积为1L的恒温密闭容器中发生上述反应,反应物浓度随时间变化关系如下图所示.X与Y两条曲线中,Y表示N2O4浓度随时间的变化