题目内容
7.现有金属单质A和气体甲、乙、丙及物质B、C、D、E、F、G,它们之问能发生如下反应,其中乙是黄绿色气体(图中有些反应的产物和反应的条件没有全部标出).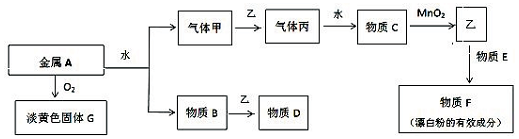
请根据以上信息回答下列问题:
(1)写出下列物质的名称:丙氯化氢;
(2)写出下列物质的化学式:FCa(ClO)2;
(3)气体乙是一种重要的化工原料,在工农业牛产、牛活中有着重要的应用.请你根据所学知识回答下列问题:
①把气体乙通入紫色石蕊溶液中,可以观察到的现象是:先变红后褪色,请你解释其中的原因氯气和水反应生成HCl、HClO,溶液显酸性使石蕊变红HClO具有漂白性(或强氧化性)使溶液褪色.
②某化学兴趣小组计划用气体乙和物质B制取简易消毒液D.其反应原理为:(用化学方程式表示)Cl2+2NaOH=NaCl+NaClO+H2O.
分析 金属单质A和气体甲、乙、丙及物质B、C、D、E、F、G,乙是黄绿色气体,则乙是Cl2;A和氧气反应生成淡黄色固体G,则A是Na、G是Na2O2;A和水反应生成气体甲和B,则A是H2、B是NaOH;氢气和氯气反应生成丙为HCl,C是盐酸,浓盐酸和二氧化锰在加热条件下反应生成氯气,氯气和E反应生成F,F为漂白粉的有效成分,为Ca(ClO)2,所以E是Ca(OH)2,某化学兴趣小组计划用气体乙和物质B制取简易消毒液D,则D是NaClO和NaCl,再结合题目分析解答.
解答 解:金属单质A和气体甲、乙、丙及物质B、C、D、E、F、G,乙是黄绿色气体,则乙是Cl2;A和氧气反应生成淡黄色固体G,则A是Na、G是Na2O2;A和水反应生成气体甲和B,则A是H2、B是NaOH;氢气和氯气反应生成丙为HCl,C是盐酸,浓盐酸和二氧化锰在加热条件下反应生成氯气,氯气和E反应生成F,F为漂白粉的有效成分,为Ca(ClO)2,所以E是Ca(OH)2,某化学兴趣小组计划用气体乙和物质B制取简易消毒液D,则D是NaClO和NaCl,
(1)通过以上分析知,丙是氯化氢,故答案为:氯化氢;
(2)F是漂白粉的有效成分为Ca(ClO)2,故答案为:Ca(ClO)2;
(3)①氯气和水反应生成HCl和HClO,溶液呈酸性,HClO具有漂白性,所以将乙通入紫色石蕊试液中,酸使石蕊变红色,次氯酸使红色褪色,所以看到的现象是先变红后褪色,
故答案为:先变红后褪色;氯气和水反应生成HCl、HClO,溶液显酸性使石蕊变红HClO具有漂白性(或强氧化性)使溶液褪色;
②氯气和NaOH反应生成NaCl和NaClO,NaClO具有漂白性,发生的反应为Cl2+2NaOH=NaCl+NaClO+H2O,故答案为:Cl2+2NaOH=NaCl+NaClO+H2O.
点评 本题以氯气及其化合物之间的转化为载体考查无机物推断,侧重考查学生分析推断及知识综合运用能力,根据物质特殊颜色、特殊性质进行推断,注意基础知识的积累和运用,题目难度不大.

 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案能表示该反应已达平衡状态的是( )
| A. | 2V正(B)=V逆(D) | |
| B. | 混合气体的密度保持不变 | |
| C. | 混合气体中B、C、D的浓度之比为2:2:1 | |
| D. | 混合气体的压强不随时间变化而变化 |
| A. | 防止废旧电池重金属盐对土壤水资源造成污染,大力开发废旧电池综合利用技术 | |
| B. | 为减少北方雾霾,作物秸秆禁止直接野外燃烧,研究开发通过化学反应转化为乙醇用作汽车燃料 | |
| C. | 为节约垃圾处理的费用,大量采用垃圾的填埋 | |
| D. | 为减少温室气体排放,应减少燃煤.大力发展新能源,如核能、风能、太阳能 |
| A. | 100 mL 2 mol/L的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变 | |
| B. | 用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快产生氢气的速率 | |
| C. | 汽车尾气中的CO和NO可以缓慢反应生成N2和CO2,加入催化剂,不影响CO的转化率 | |
| D. | 二氧化硫的催化氧化是一个放热反应,升高温度,平衡逆向移动,正反应速率减慢 |
X$\stackrel{M}{→}$Y$\stackrel{M}{→}$Z
①S单质 ②C单质 ③NaOH ④NH3.
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
| A. | 4 mol A+2 mol B | |
| B. | 1 mol B+3 mol C+1 mol D | |
| C. | 3 mol C+2 mol D | |
| D. | 1 mol A+0.5 mol B+1.5 mol C+0.5 mol D |
| 时间(min) 物质的量(mol) | 0 | 10 | 20 | 30 | 40 | 50 |
| B | 2.00 | 1.36 | 1.00 | 1.00 | 1.20 | 1.20 |
| D | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
| E | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
(2)30min后,只改变某一条件,反应重新达到平衡,根据表中的数据判断改变的条件可能是ae(填字母编号).
a.通入一定量的B b.加入一定量的固体A c.适当缩小容器的体积
d.升高反应体系温度 e.同时加入0.2molB、0.1molD、0.1molE
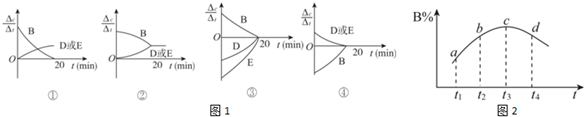
(3)对于该反应,用各物质表示的反应速率与时间的关系示意曲线为图1中的④(填序号).
(4)维持容器的体积和温度T1不变,当向该容器中加入1.60 mol B、0.20 mol D、0.20 mol E和nmolA,达到平衡后,与表格中20分钟时各物质的浓度完全相同时,则投入固体A的物质的量n的取值范围是>0.3.
(5)维持容器的体积和温度T1不变,各物质的起始物质的量为n(A)=1.0 mol,n(B)=3.0 mol,n(D)=a mol,达到平衡后,n(E)=0.50 mol,则a=1.5.
(6)若该密闭容器绝热,实验测得B的转化率B%随时间变化的示意图如图2所示.由图可知,Q小于0(填“大于”或“小于”),c点v正等于v逆(填“大于”“小于”或“等于”).