题目内容
下列各微粒中,核外电子总数相等的是( )
| A、CO2 和 NO2 |
| B、H2S 和 H2O |
| C、NH4+ 和 H2O |
| D、N2 和 C2H4 |
考点:原子核外电子排布
专题:原子组成与结构专题
分析:分子和原子中,质子数等于核外电子数,而阳离子的电子数=质子数-电荷数,结合分子的构成及原子的质子数计算.
解答:
解:A、CO2 和 NO2的核外电子数分别为6+16=22、7+16=23,故A不选;
B、H2S和H2O的核外电子数分别为2+16=18、2+8=10,故B不选;
C、NH4+ 和 H2O的核外电子数分别为7+4-1=10、2+8=10,故C可选;
D、N2 和 C2H4的核外电子数分别为7×2=14、12+4=16,故D不选.
故选:C.
B、H2S和H2O的核外电子数分别为2+16=18、2+8=10,故B不选;
C、NH4+ 和 H2O的核外电子数分别为7+4-1=10、2+8=10,故C可选;
D、N2 和 C2H4的核外电子数分别为7×2=14、12+4=16,故D不选.
故选:C.
点评:本题考查核外电子数的计算,把握原子的质子数及质子数与核外电子数的关系为解答的关键,注意分子的构成及阳离子与电子数的关系,题目难度不大.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目
如图是产生和收集气体的实验装置,该装置适合于( )
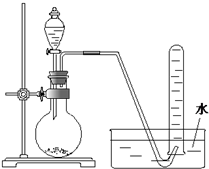

| A、用H2O2溶液和MnO2反应制取O2 |
| B、用浓盐酸和MnO2反应制取Cl2 |
| C、用稀硫酸与石灰石反应制取CO2 |
| D、用NH4Cl和Ca(OH)2反应制取NH3 |
核外电子分层排布的主要原因是( )
| A、电子的质量不同 |
| B、电子的能量不同 |
| C、电子的数量不同 |
| D、电子的大小不同 |
下列分子或离子中中心原子为用来成键的电子对最多的是( )
| A、NH4+ |
| B、NH3 |
| C、H2O |
| D、BCl3 |
 )、Cl-、H2O形成的配合物为
)、Cl-、H2O形成的配合物为 .
. 是氮元素的最高价含氧酸的结构,该物质易溶于水的原因是
是氮元素的最高价含氧酸的结构,该物质易溶于水的原因是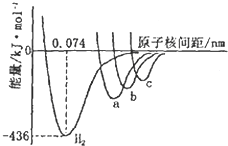 X元素在第3周期中电负性最大,Y、Z元素同主族且位置相邻,Y原子的最外层电子排布为nsnnpn+2.请填写下列空白.
X元素在第3周期中电负性最大,Y、Z元素同主族且位置相邻,Y原子的最外层电子排布为nsnnpn+2.请填写下列空白.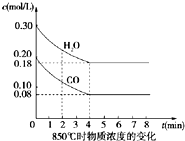 在一体积为10L密闭的容器中,通入一定量的CO和H2O(g),在850℃时发生以下反应:
在一体积为10L密闭的容器中,通入一定量的CO和H2O(g),在850℃时发生以下反应: