题目内容
下列分子或离子中中心原子为用来成键的电子对最多的是( )
| A、NH4+ |
| B、NH3 |
| C、H2O |
| D、BCl3 |
考点:原子核外电子排布
专题:原子组成与结构专题
分析:四中分子或离子中没有形成π键的,对于ABn型分子或离子的中心原子的成键电子对数为n,以此分析.
解答:
解:A、NH4+的中心原子的成键电子对数为4;
B、NH3的中心原子的成键电子对数为3;
C、H2O的中心原子的成键电子对数为2;
D、BCl3的中心原子的成键电子对数为3;
故选A.
B、NH3的中心原子的成键电子对数为3;
C、H2O的中心原子的成键电子对数为2;
D、BCl3的中心原子的成键电子对数为3;
故选A.
点评:本题考查了中心原子成键电子对的计算,难度不大,注意成键电子对为共价键的数目.

练习册系列答案
相关题目
下列各微粒中,核外电子总数相等的是( )
| A、CO2 和 NO2 |
| B、H2S 和 H2O |
| C、NH4+ 和 H2O |
| D、N2 和 C2H4 |
下列分子或离子中,不含有孤对电子的是( )
| A、H2O |
| B、H3O+ |
| C、NH3 |
| D、NH4+ |
下列各原子的电子排布式正确的是( )
| A、Fe[Ar]3d54s3 |
| B、F-1s22s22p5 |
| C、k[Ar]3d1 |
| D、p 1s22s22p63s23p3 |
实验室里可按如图所示的装置干燥、储存气体R,多余的气体可用水吸收,则R是( )

| A、NO2 |
| B、HCl |
| C、CH4 |
| D、NH3 |
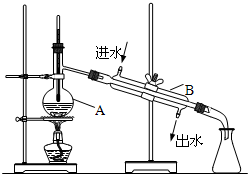 如图为实验室制取自来水的装置示意图,根据图示回答下列问题.
如图为实验室制取自来水的装置示意图,根据图示回答下列问题.