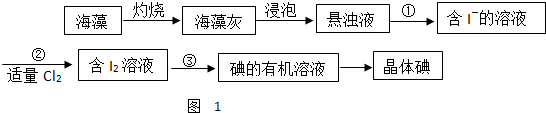
题目内容
 X元素在第3周期中电负性最大,Y、Z元素同主族且位置相邻,Y原子的最外层电子排布为nsnnpn+2.请填写下列空白.
X元素在第3周期中电负性最大,Y、Z元素同主族且位置相邻,Y原子的最外层电子排布为nsnnpn+2.请填写下列空白.(1)写出X元素M层的电子排布式
(2)XY2是一种高效安全的消毒剂,熔点-59.5℃,沸点10℃,构成该晶体的微粒之间的作用力是
(3)ZX2常用于有机合成.ZX2分子的空间构型是
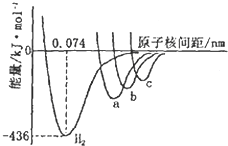
(4)如图中四条曲线分别表示H2、Cl2、Br2、I2分子的形成过程中能量随原子核间距的变化关系,其中表示Cl2的是曲线
考点:原子核外电子排布,判断简单分子或离子的构型,“等电子原理”的应用,不同晶体的结构微粒及微粒间作用力的区别
专题:化学键与晶体结构
分析:X元素在第3周期中电负性最大,所以X为Cl元素,Y原子的最外层电子排布为nsnnpn+2,所以n=2,即Y为O元素,Y、Z元素同主族且位置相邻,所以Z为S元素.
(1)Cl为17号元素,位于第三周期第ⅤⅡA族;
(2)根据晶体的结构性质分析,ClO2熔沸点较低,属于分子晶体;
(3)SCl2分子中S原子形成2个δ键,其电子对数=2+
=4,有两对孤电子对,所以分子构型为V型;
(4)图是表示H2、Cl2、Br2、I2四种分子形成过程中能量随核间距的变化情况的图象,其中表示Cl2的曲线的是a,因为Cl、Br、I三种原子中,Cl元素的原子半径最小,原子间形成分子时键长最短.
(1)Cl为17号元素,位于第三周期第ⅤⅡA族;
(2)根据晶体的结构性质分析,ClO2熔沸点较低,属于分子晶体;
(3)SCl2分子中S原子形成2个δ键,其电子对数=2+
| 6-1×2 |
| 2 |
(4)图是表示H2、Cl2、Br2、I2四种分子形成过程中能量随核间距的变化情况的图象,其中表示Cl2的曲线的是a,因为Cl、Br、I三种原子中,Cl元素的原子半径最小,原子间形成分子时键长最短.
解答:
解:由分析知X、Y、Z分别为Cl、O、S元素,
(1)Cl为17号元素,位于第三周期第ⅤⅡA族,故其M层电子排布式为3s23p5;
故答案为:3s23p5;
(2)ClO2熔点-59.5℃,沸点10℃,可知熔沸点较低,其晶体类型为分子晶体,构成晶体的微粒间作用力为范德华力;
故答案为:范德华力;
(3)SCl2分子中S原子形成2个δ键,其电子对数=2+
=4,有两对孤电子对,所以分子构型为V型;
SCl2分子中价电子数为20,故其等电子体有OF2和ClO2-;
故答案为:V型;OF2;ClO2-;
(4)图是表示H2、Cl2、Br2、I2四种分子形成过程中能量随核间距的变化情况的图象,其中表示Cl2的曲线的是a,因为Cl、Br、I三种原子中,Cl元素的原子半径最小,原子间形成分子时键长最短.
故答案为:a;Cl、Br、I三种原子中Cl原子半径最小,原子间形成分子时键长最短.
(1)Cl为17号元素,位于第三周期第ⅤⅡA族,故其M层电子排布式为3s23p5;
故答案为:3s23p5;
(2)ClO2熔点-59.5℃,沸点10℃,可知熔沸点较低,其晶体类型为分子晶体,构成晶体的微粒间作用力为范德华力;
故答案为:范德华力;
(3)SCl2分子中S原子形成2个δ键,其电子对数=2+
| 6-1×2 |
| 2 |
SCl2分子中价电子数为20,故其等电子体有OF2和ClO2-;
故答案为:V型;OF2;ClO2-;
(4)图是表示H2、Cl2、Br2、I2四种分子形成过程中能量随核间距的变化情况的图象,其中表示Cl2的曲线的是a,因为Cl、Br、I三种原子中,Cl元素的原子半径最小,原子间形成分子时键长最短.
故答案为:a;Cl、Br、I三种原子中Cl原子半径最小,原子间形成分子时键长最短.
点评:本题综合考查原子结构与性质知识,侧重于元素周期律、晶体类型以及电子排布等知识的考查,为高考常见题型,注意把握原子结构特点,明确元素的种类为解答该题的关键,难度中等.

练习册系列答案
相关题目
下列各微粒中,核外电子总数相等的是( )
| A、CO2 和 NO2 |
| B、H2S 和 H2O |
| C、NH4+ 和 H2O |
| D、N2 和 C2H4 |
 到2013午云南已连续4年干旱,专家认为云南和其他城市一样受到全球变暖的气候变化影响.CO2等温室气体是导致全球变暖的主要原因,控制和治理CO2是解决温室效应的有效途径.
到2013午云南已连续4年干旱,专家认为云南和其他城市一样受到全球变暖的气候变化影响.CO2等温室气体是导致全球变暖的主要原因,控制和治理CO2是解决温室效应的有效途径.
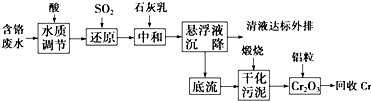 含铬废水、铬渣对环境的污染问题备受关注,通过化学原理对废物进行有效处理变废为宝是目前的一个重要研究课题.
含铬废水、铬渣对环境的污染问题备受关注,通过化学原理对废物进行有效处理变废为宝是目前的一个重要研究课题.