题目内容
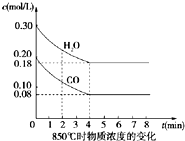 在一体积为10L密闭的容器中,通入一定量的CO和H2O(g),在850℃时发生以下反应:
在一体积为10L密闭的容器中,通入一定量的CO和H2O(g),在850℃时发生以下反应:CO(g)+H2 O(g)=CO2(g)+H2(g)△H<0
(1)CO和H2O浓度变化如图,则0~4min的平均反应速率v(CO)=
当下列哪些物理量不再发生变化时,表明上述反应已达到平衡状态的是
A.混合气体的压强 B.混合气体的密度 C.CO的物质的量浓度D.密闭容器中放出热量 E.v(CO)与v(CO2)的比值.
考点:化学平衡的计算,化学平衡状态的判断
专题:化学平衡专题
分析:(1)v=
进行计算;平衡时,c(H2O)=0.18mol/L,c(CO)=0.08mol/L,c(H2)=c(CO2)=(0.30-0.18)mol/L=0.12mol/L,
K=
,降低温度平衡向放热反应方向移动;
(2)平衡标志是正逆反应速率相同,个组分含量保持不变,结合反应特征分析选项.
| △c |
| △t |
K=
| c(H2)c(CO2) |
| c(CO)c(H2O) |
(2)平衡标志是正逆反应速率相同,个组分含量保持不变,结合反应特征分析选项.
解答:
解:(1)(1)v=
=
=0.03 mol/(L.min),
平衡时,c(H2O)=0.18mol/L,c(CO)=0.08mol/L,c(H2)=c(CO2)=(0.30-0.18)mol/L=0.12mol/L,
K=
=
=1;
故答案为:0.03;1;
(2)CO(g)+H2 O(g)=CO2(g)+H2(g)△H<0,反应是气体体积不变的放热反应,结合平衡移动原理分析选项,当正逆反应速率相同反应达到平衡状态;
A.反应前后气体体积不变,混合气体的压强在反应过程中和平衡状态下始终不变,故A错误;
B.反应前后气体体积和足量始终不变,混合气体的密度不变不能说明反应达到平衡状态,故B错误;
C.CO的物质的量浓度不变是平衡标志,故C正确;
D.反应放热和反应的反应物的量有关,密闭容器中放出热量不变说明反应达到平衡状态,故D正确;
E.v(CO)与v(CO2)的比值和起始量、变化量有关,比值不变不能说明反应达到平衡状态,故E错误;
故选CD.
| △c |
| △t |
| (0.020-0.080)mol/L |
| 4min |
平衡时,c(H2O)=0.18mol/L,c(CO)=0.08mol/L,c(H2)=c(CO2)=(0.30-0.18)mol/L=0.12mol/L,
K=
| c(H2)c(CO2) |
| c(CO)c(H2O) |
| 0.12×0.12 |
| 0.18×0.08 |
故答案为:0.03;1;
(2)CO(g)+H2 O(g)=CO2(g)+H2(g)△H<0,反应是气体体积不变的放热反应,结合平衡移动原理分析选项,当正逆反应速率相同反应达到平衡状态;
A.反应前后气体体积不变,混合气体的压强在反应过程中和平衡状态下始终不变,故A错误;
B.反应前后气体体积和足量始终不变,混合气体的密度不变不能说明反应达到平衡状态,故B错误;
C.CO的物质的量浓度不变是平衡标志,故C正确;
D.反应放热和反应的反应物的量有关,密闭容器中放出热量不变说明反应达到平衡状态,故D正确;
E.v(CO)与v(CO2)的比值和起始量、变化量有关,比值不变不能说明反应达到平衡状态,故E错误;
故选CD.
点评:本题考查了化学反应速率、化学平衡常数概念的计算应用,平衡标志的理解分析,掌握基础是关键,题目较简单.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
下列各微粒中,核外电子总数相等的是( )
| A、CO2 和 NO2 |
| B、H2S 和 H2O |
| C、NH4+ 和 H2O |
| D、N2 和 C2H4 |
已知:五种(1~20号)元素的部分电离能数据(单位:kJ?mol-1),
推测上述五种元素,处于周期表中同一族的是( )
| 元素代号 | I1 | I2 | I3 | I4 |
| X | 2080 | 4000 | 6100 | 9400 |
| Y | 500 | 4600 | 6900 | 9500 |
| Z | 740 | 1500 | 7700 | 10500 |
| M | 580 | 1800 | 2700 | 11600 |
| N | 420 | 4100 | 6400 | 8900 |
| A、X和Y | B、Y和N |
| C、M和N | D、Y和M |
下列各原子的电子排布式正确的是( )
| A、Fe[Ar]3d54s3 |
| B、F-1s22s22p5 |
| C、k[Ar]3d1 |
| D、p 1s22s22p63s23p3 |
 含铬废水、铬渣对环境的污染问题备受关注,通过化学原理对废物进行有效处理变废为宝是目前的一个重要研究课题.
含铬废水、铬渣对环境的污染问题备受关注,通过化学原理对废物进行有效处理变废为宝是目前的一个重要研究课题. 如图为实验室制取自来水的装置示意图,根据图示回答下列问题.
如图为实验室制取自来水的装置示意图,根据图示回答下列问题.