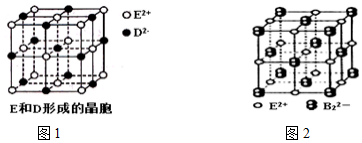
题目内容
10.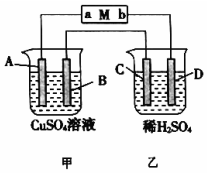 如图所示装置中,当线路接通时,发现M 滤纸(用Na2SO4溶液的石蕊试液浸润过)的a端显蓝色,b端显红色,且知甲中电极材料是锌、银,乙中电极材料是铂、铜,且乙中两电极不发生变化.回答:
如图所示装置中,当线路接通时,发现M 滤纸(用Na2SO4溶液的石蕊试液浸润过)的a端显蓝色,b端显红色,且知甲中电极材料是锌、银,乙中电极材料是铂、铜,且乙中两电极不发生变化.回答:(1)甲、乙分别是什么装置?原电池、电解池.
(2)写出A、B、C、D的电极名称以及电极材料和电极反应式.
A极:(负极Zn ):Zn-2e-=Zn2+; B极:(正极Ag):Cu2++2e-=Cu;
C极:(阳极Pt):4OH-+4e-=2H2O+O2↑; D极:(阴极Cu):2H++2e-=H2↑.
分析 发现M(用Na2SO4溶液的石蕊试液浸润过)a端显蓝色,则a端为碱性,氢离子放电,为阴极,b端显红色,则b端为酸性,氢氧根离子放电,是阳极,和电源的正极相连的是阳极,和电源的负极相连的是阴极,根据原电池、电解池的构成条件以及工作原理知识来回答.
解答 解:发现M(用Na2SO4溶液的石蕊试液浸润过)a端显蓝色,则a端为碱性,氢离子放电,为阴极,b端显红色,则b端为酸性,氢氧根离子放电,是阳极,和电源的正极相连的是阳极,和电源的负极相连的是阴极,即a是阴极,b是阳极,
(1)甲中电极材料是锌-银,金属锌可以和硫酸铜之间发生置换反应,属于自发的氧化还原反应,所以该装置属于原电池,金属锌是负极,和a相连,银是正极,乙中电极材料是铂-铜,且乙中两极不发生变化,该装置属于电解池,金属铜是阴极,为D电极,Pt是阳极材料,
故答案为:原电池;电解池;
(2)A装置属于原电池,金属锌是负极,和a相连,即为A极,电极方程式为Zn-2e-=Zn2+,银是正极,即为B极,电极方程式为Cu2++2e-=Cu,乙中电极材料是铂-铜,且乙中两极不发生变化,该装置属于电解池,金属铜是阴极,为D电极,阴极上氢离子得电子生成氢气,其电极方程式为2H++2e-=H2↑,Pt是阳极材料,即为C电极,C极上氢氧根离子失电子生成氧气,其电极方程式为:4OH-+4e-=2H2O+O2↑;
故答案为:(负极Zn ):Zn-2e-=Zn2+;(正极Ag):Cu2++2e-=Cu;(阳极Pt):4OH-+4e-=2H2O+O2↑;(阴极Cu):2H++2e-=H2↑.
点评 本题考查了原电池和电解池原理,明确各个电极上发生的电极反应是解本题关键,根据电极的确定以及电极变化现象来回答,题目难度中等,侧重于考查学生的分析能力和对基础知识的应用能力.

 阅读快车系列答案
阅读快车系列答案| 选项 | A | B | C | D |
| 图片 |  |  |  |  |
| 生活中的应用 | 食品包装袋放有小袋铁粉 | 红酒中添加规定量的 SO2 | 饼干包装盒内放有小袋硅胶 | 口服补血剂(琥珀酸亚铁)并同时服维生素 C |
| 作用 | 铁粉有抗氧化 的作用 | SO2有漂白性的作用 | 硅胶有吸水的作 用 | 维生素 C 有防止 Fe2+被 氧化的作用 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 44g乙醛中所含的氧原子数为NA | |
| B. | 足量的铜与40mL10mol/L硝酸反应,生成气体的分子数为0.2NA | |
| C. | 14g乙稀中所含的C-H键数目为2NA | |
| D. | 0.1molNH3中所含的电子数为NA |
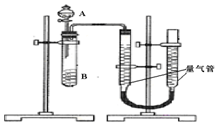 甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.
甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):
甲组:通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小某同学进行实验,实验装置如图.其中A、B的成分见表
| 序号 | A溶液 | B溶液 |
| ① | 2mL0.2mol/LH2C2O4溶液 | 4mL0.01mol/LKMnO4溶液 |
| ② | 2mL0.1mol/LH2C2O4溶液 | 4mL0.01mol/LKMnO4溶液 |
| ③ | 2mL0.2mol/LH2C2O4溶液 | 4mL0.01mol/LKMnO4溶液和少量MnSO4 |
(2)实验开始前需要检查气密性.分液漏斗中A溶液应该一次性加入(填“一次性”或“逐滴滴加”)
(3)完成该实验还需要秒表(或计时器)(填仪器名称),实验结束后读数前需要移动量气管,使两个量气管的液面相平.
乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率为了探究KMnO4与H2C2O4浓度对反应速率的影响,某同学在室温下完成以下实验
| 实验编号 | 1 | 2 | 3 | 4 |
| 水/mL | 10 | 5 | 0 | X |
| 0.5mol/L H2C2O4/mL | 5 | 10 | 10 | 5 |
| 0.2mol/L KMnO4/mL | 5 | 5 | 10 | 10 |
| 时间/s | 40 | 20 | 10 | --- |
(5)2号反应中,H2C2O4的反应速率为0.00625mol/(L•s).
(6)在实验中发现高锰酸钾酸性溶液和草酸溶液反应时,开始一段时间反应速率较慢,
溶液褪色不明显;但不久突然褪色,反应速率明显加快.某同学认为是放热导致溶液温度升高所致,重做3号实验,测定过程中溶液不同时间的温度,结果如表:
| 时间/s | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| 温度/℃ | 25 | 26 | 26 | 26 | 26.5 | 27 | 27 |
(7)从影响化学反应速率的因素看,你的猜想还可能是催化剂的影响.若用实验证明你的猜想,除了酸性高锰酸钾溶液和草酸溶液外,还需要选择的试剂最合理的是D(填字母).
A.硫酸钾 B.水 C.二氧化锰 D.硫酸锰.
| A. | 50g 98%的硫酸中含有氧原子数目为2NA | |
| B. | 1L0.1 mol•L-1氨水中含有OH-的数目为0.1NA | |
| C. | 标准状况下,22.4L由CCl4和CH2O组成的混合物中含碳原子数目为NA | |
| D. | 常温常压下,足量的Al与1 molCl2共热充分反应后,转移电子数目为2NA |
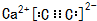 .
.