题目内容
19.在标准状况下,有密度为0.478g/L的乙烯、乙炔、氢气的混合气,在加热条件下通过镍催化剂完全反应后再冷却到标准状况时,测得其密度为1.062g/L,则原混合气中各组分的体积分数分别是C2H4、C2H2、H2的体积分数分别为15%、20%、65%.分析 乙烯、乙炔和氢气的混合气体,测得其在标准状况下的密度为0.478g/L,则平均分子质量=0.478×22.4=10.7;使该混合气体在加热的条件下通过镍催化剂并充分反应,再冷却到标准状况下测其密度为1.062g/L,则平均分子质量=1.062×22.4=23.8,比乙炔的相对分子量还小,说明反应后氢气还过量,所以反应后混合气体由C2H6和H2组成,根据反应C2H4+H2→C2H6,C2H2+2H2→C2H6 化学反应方程式进行计算.
解答 解:乙烯、乙炔和氢气的混合气体,测得其在标准状况下的密度为0.478g/L,则平均分子质量=0.478×22.4=10.7;使该混合气体在加热的条件下通过镍催化剂并充分反应,再冷却到标准状况下测其密度为1.062g/L,则平均分子质量=1.062×22.4=23.8,比乙炔的相对分子量还小,说明反应氢气还过量,所以反应后混合气体由C2H6和H2组成,根据反应C2H4+H2→C2H6,C2H2+2H2→C2H6
设反应后H2的体积分数为x,则C2H6的体积分数为(1-x).依题意:
2x+30×(1-x)=23.8,解得x=0.221.
又设反应前混合气体体积是YL,则同温、同压下反应后的气体体积为:0.478Y÷1.062=0.45YL.
反应后,H2的体积为0.45Y×0.221=0.1YL,C2H6的体积为0.35Y L.
再设反应前混合气体中C2H4、C2H2、H2分别为aL、bL、cL,根据化学反应方程式,有
$\left\{\begin{array}{l}{a+b+c=Y}\\{a+b=0.35Y}\\{c-a-2b=0.1Y}\end{array}\right.$
解得a=0.15Y;b=0.2Y;c=0.65Y;
所以原混合气体中,C2H4、C2H2、H2的体积分数分别为$\frac{0.15Y}{Y}$×100%=15%、$\frac{0.2Y}{Y}$×100%=20%、$\frac{0.65Y}{Y}$×100%=65%,
故答案为:C2H4、C2H2、H2的体积分数分别为15%、20%、65%.
点评 本题主要考查了燃烧的相关计算以及气体体积分数的计算,难度较大,列方程组进行解题就可以迅速解题.

| A. | 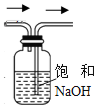 装置可用于除去NO气体中的NO2杂质 | |
| B. |  向图装置的溶液中滴入KSCN溶液不变红色,可以说明铁还没有发生吸氧腐蚀 | |
| C. | 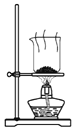 装置用于灼烧碎海带以证明海带中存在I- | |
| D. | 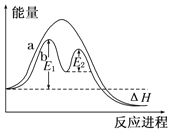 图中的E1可表示有催化剂存在的条件下,对应反应的活化能 |
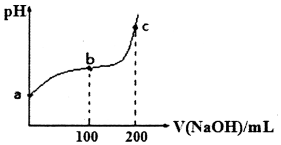
| A. | b~c段,随着NaOH溶液的滴入,$\frac{c(HClO)}{c(Cl{O}^{-})}$逐渐增大 | |
| B. | 若a点pH=4,且c(Cl-)=100c(ClO-),则Ka(HClO)=$\frac{1{0}^{-4}}{101}$ | |
| C. | b点对应的溶液可用pH试纸测定其pH | |
| D. | c点对应的溶液中:c(Na+)>c(OH-)>c(C1-)>c(C1O-)>c(H+) |
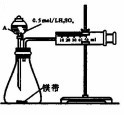 用如图所示的装置来测定镁与硫酸反应的速率,在锥形瓶中加入0.7g镁带,按图连接好装置,从A中加入20.0mL0.5mol/LH2SO4.记录注射器活塞的位置和相应的时间.实验记录如下:
用如图所示的装置来测定镁与硫酸反应的速率,在锥形瓶中加入0.7g镁带,按图连接好装置,从A中加入20.0mL0.5mol/LH2SO4.记录注射器活塞的位置和相应的时间.实验记录如下:| 时间/s | t | 2t | … |
| 活塞的位置/mL | 25.6 | 36.0 | … |
(2)仪器A的名称为分液漏斗.
(3)0~t时间段与t~2t时间段,化学反应速率快的是t~2t;原因是镁与硫酸反应放热,温度升高,反应速率加快.
(4)用上述装置探究Fe3+、Cu2+对双氧水分解反应速率的影响,所用试剂:5%H2O2、0.1mol/LFeCl3/0.2mol/L CuCl2,完成下表的实验设计:
| 实验序号 | 双氧水体积/mL | 蒸馏水体积/mL | 添加的物质 |
| 1 | 10 | 0 | 4mLFeCl3 |
| 2 | 10 | 2 | 2mLCuCl2 |
②本实验需测定的数据是收集相同体积的氧气所需时间;
③A中装有10mL双氧水,未减少误差,加入其它物质的方法是连接分液漏斗前,直接加到锥形瓶中.
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | 纳米铁粉有很好的吸附性 | 纳米铁粉可以高效地去除被污染水体中 的Pb2+、Cu2+、Cd2+、Hg2+等重金属离子 |
| B | 硅胶可以和水发生化学反应 | 硅胶作袋装食品的干燥剂 |
| C | SO3有毒 | 不能做食品防腐剂 |
| D | 肥皂水显碱性 | 肥皂水作蚊虫叮咬处的清洗剂 |
| A. | A | B. | B | C. | C | D. | D |
| 事 实 | 结 论 | |
| A | HClO与H2SO3反应生成H2SO4和HCl | 非金属性:Cl>S |
| B | N2比白磷稳定得多 | 非金属性:N<P |
| C | 在约800℃时,金属钠可从熔融的KCl中置换出K | 金属性:Na>K |
| D | 工业上电解Na3AlF6和Al2O3的熔融混合物得到Al | 金属活动性:Na>Al |
| A. | A | B. | B | C. | C | D. | D |
| A. | 1.0 L 1.0 mol•L-1 的NaAlO2水溶液中含有的氧原子数为2NA | |
| B. | 25℃时,10L pH=13的Ba(OH)2溶液中含有的OH-数为2NA | |
| C. | 常温常压下,11g D218O中所含中子数为6NA | |
| D. | 某无水乙醇与足量金属钠反应生成5.6L H2,则该乙醇分子中共价键总数为4NA |
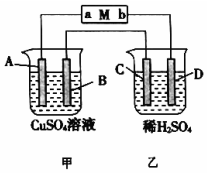 如图所示装置中,当线路接通时,发现M 滤纸(用Na2SO4溶液的石蕊试液浸润过)的a端显蓝色,b端显红色,且知甲中电极材料是锌、银,乙中电极材料是铂、铜,且乙中两电极不发生变化.回答:
如图所示装置中,当线路接通时,发现M 滤纸(用Na2SO4溶液的石蕊试液浸润过)的a端显蓝色,b端显红色,且知甲中电极材料是锌、银,乙中电极材料是铂、铜,且乙中两电极不发生变化.回答: