题目内容
15.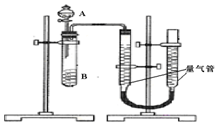 甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.
甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):
甲组:通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小某同学进行实验,实验装置如图.其中A、B的成分见表
| 序号 | A溶液 | B溶液 |
| ① | 2mL0.2mol/LH2C2O4溶液 | 4mL0.01mol/LKMnO4溶液 |
| ② | 2mL0.1mol/LH2C2O4溶液 | 4mL0.01mol/LKMnO4溶液 |
| ③ | 2mL0.2mol/LH2C2O4溶液 | 4mL0.01mol/LKMnO4溶液和少量MnSO4 |
(2)实验开始前需要检查气密性.分液漏斗中A溶液应该一次性加入(填“一次性”或“逐滴滴加”)
(3)完成该实验还需要秒表(或计时器)(填仪器名称),实验结束后读数前需要移动量气管,使两个量气管的液面相平.
乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率为了探究KMnO4与H2C2O4浓度对反应速率的影响,某同学在室温下完成以下实验
| 实验编号 | 1 | 2 | 3 | 4 |
| 水/mL | 10 | 5 | 0 | X |
| 0.5mol/L H2C2O4/mL | 5 | 10 | 10 | 5 |
| 0.2mol/L KMnO4/mL | 5 | 5 | 10 | 10 |
| 时间/s | 40 | 20 | 10 | --- |
(5)2号反应中,H2C2O4的反应速率为0.00625mol/(L•s).
(6)在实验中发现高锰酸钾酸性溶液和草酸溶液反应时,开始一段时间反应速率较慢,
溶液褪色不明显;但不久突然褪色,反应速率明显加快.某同学认为是放热导致溶液温度升高所致,重做3号实验,测定过程中溶液不同时间的温度,结果如表:
| 时间/s | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| 温度/℃ | 25 | 26 | 26 | 26 | 26.5 | 27 | 27 |
(7)从影响化学反应速率的因素看,你的猜想还可能是催化剂的影响.若用实验证明你的猜想,除了酸性高锰酸钾溶液和草酸溶液外,还需要选择的试剂最合理的是D(填字母).
A.硫酸钾 B.水 C.二氧化锰 D.硫酸锰.
分析 (1)KMnO4酸性溶液与H2C2O4溶液反应生成二氧化碳、硫酸锰和水;
(2)无论避免影响测定结果,分液漏斗中的A溶液不能逐滴加入;
(3)判断反应速率需要时间,用秒表计时;
(4)探究浓度对反应速率的影响时,溶液的总体积都为20mL,据此判断X值;由于4号实验中高锰酸钾过量,则溶液没有褪色;
(5)根据n=cV计算出反应物的物质的量,然后根据不足量计算出反应消耗的草酸的物质的量,最后根据v=$\frac{△c}{△t}$计算出H2C2O4的反应速率;
(6)根据表中数据知,20s时温度不最高,但20s前突然褪色;
(7)考虑锰离子有催化作用,要想验证锰离子的催化作用,再加入硫酸锰即可.
解答 解:(1)KMnO4酸性溶液与H2C2O4溶液反应生成二氧化碳、硫酸锰和水,该反应的离子方程式为:2MnO4-+5H2C2O4+6H+═2Mn2++10CO2+8H2O.
故答案为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
(2)为了避免实验误差,实验过程中分液漏斗中的溶液A必须一次性加入,不能逐滴加入,
故答案为:一次性;
(3)根据反应速率v=$\frac{△c}{△t}$可知,需要测定时间从而判断反应速率大小,需要用秒表(或计时器)计时,
故答案为:秒表(或计时器)
(4)为了探究KMnO4与H2C2O4浓度对反应速率的影响,实验1-4中溶液的总体积应该为20,则X=20-10-5=5;根据反应2MnO4-+5H2C2O4+6H+═2Mn2++10CO2+8H2O可知,10mL酸性高锰酸钾需要消耗10mL草酸溶液,所以实验4中高锰酸钾过量,导致溶液没有褪色,
故答案为:5;KMnO4溶液过量;
(5)2号实验中草酸的物质的量为:0.5mol/L×0.01L=0.005mol,高锰酸钾的物质的量为:0.2mol/L×0.005L=0.001mol,
根据反应2MnO4-+5H2C2O4+6H+═2Mn2++10CO2+8H2O可知,高锰酸钾不足,所以反应中消耗的草酸的物质的量为:0.001mol×$\frac{5}{2}$=0.0025mol,
2号反应中,H2C2O4的反应速率为:v(H2C2O4)=$\frac{\frac{0.0025mol}{0.02L}}{20s}$=0.00625mol/(L•s),
故答案为:0.00625mol/(L•s);
(6)根据表中数据知,20s时温度不最高,但20s前突然褪色,说明温度不是反应速率突然加快的原因,
故答案为:温度不是反应速率突然加快的原因;
(7)KMnO4与H2C2O4反应生成硫酸锰,锰离子有催化作用,所以猜想还可能是催化剂的作用,要想验证锰离子的催化作用,在做对比实验时同时加入硫酸锰观察反应速率是否变化即可,故选D,
故答案为:催化剂;D.
点评 本题考查了探究温度、催化剂对反应速率的影响、化学反应速率的计算、氧化还原反应及影响反应速率的因素等知识,题目难度中等,注意掌握影响化学反应速率的因素,注意控制变量法研究影响因素,把握表格中的数据分析及应用,题目知识点较多、综合性较强,充分考查了学生的分析、理解能力及化学实验、化学计算能力.

| A. |  制NH3 | B. |  干燥NH3 | C. |  收集NH3 | D. |  吸收NH3 |
【提出问题】氧化铁能否作过氧化氢溶液分解的催化剂?如果能,其催化效果如何?
【实验探究】
| 实验步骤 | 实验现象 |
| I.分别量取5mL5%过氧化氢溶液放入A、B 两支试管中,向A试管中加入ag氧化铁粉末,并分别在A、B两支试管中插入带火星木条,观察现象. | A试管中产生气泡,带火星木条复燃,B试管中无明显现象 |
| II.待A试管中没有现象发生时,重新加入过氧化氢溶液,并把带火星的木条伸入试管,如此反复多次试验,观察现象. | 试管中均产生气泡,带火星木条均复燃 |
| III.将实验 II中的剩余物小心过滤,并将所得滤渣进行洗涤、干燥、称量,所得固体质量仍为ag. | / |
| IV分别量取5mL5%过氧化氢溶液放入C、D 两支试管中,向C试管中加入ag氧化铁粉末,向D试管中加入ag二氧化锰粉末,观察现象. | / |
(2)实验 III证明:氧化铁的化学性质和质量在反应前后均没有发生变化,可以作
过氧化氢分解的催化剂;
【实验评价】实验设计的目的是进行对比.
【实验拓展】
查阅资料得知,CuO、CuSO4、猪肝、马铃薯等也可以做过氧化氢溶液分解的催化剂.
下列有关催化剂的说法中正确的是BC.
A.二氧化锰只能作过氧化氢溶液分解的催化剂.
B.同一个化学反应可以有多种催化剂
C.催化剂的质量和性质在化学反应前后都不改变.
D.用作催化剂的物质不可能是其他反应的反应物或生成物.
| A. | 四种元素A、B、C、D分别为O、Ca、Na、Ar | |
| B. | 元素A、B、C两两组成的化合物可为CaO、CaO2、Na2O、Na2O2等 | |
| C. | 元素A、C简单离子的半径大小关系为A<C | |
| D. | 元素A、C电负性大小关系为A>C |
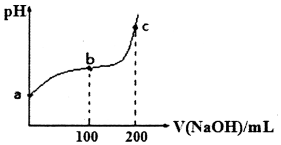
| A. | b~c段,随着NaOH溶液的滴入,$\frac{c(HClO)}{c(Cl{O}^{-})}$逐渐增大 | |
| B. | 若a点pH=4,且c(Cl-)=100c(ClO-),则Ka(HClO)=$\frac{1{0}^{-4}}{101}$ | |
| C. | b点对应的溶液可用pH试纸测定其pH | |
| D. | c点对应的溶液中:c(Na+)>c(OH-)>c(C1-)>c(C1O-)>c(H+) |
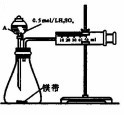 用如图所示的装置来测定镁与硫酸反应的速率,在锥形瓶中加入0.7g镁带,按图连接好装置,从A中加入20.0mL0.5mol/LH2SO4.记录注射器活塞的位置和相应的时间.实验记录如下:
用如图所示的装置来测定镁与硫酸反应的速率,在锥形瓶中加入0.7g镁带,按图连接好装置,从A中加入20.0mL0.5mol/LH2SO4.记录注射器活塞的位置和相应的时间.实验记录如下:| 时间/s | t | 2t | … |
| 活塞的位置/mL | 25.6 | 36.0 | … |
(2)仪器A的名称为分液漏斗.
(3)0~t时间段与t~2t时间段,化学反应速率快的是t~2t;原因是镁与硫酸反应放热,温度升高,反应速率加快.
(4)用上述装置探究Fe3+、Cu2+对双氧水分解反应速率的影响,所用试剂:5%H2O2、0.1mol/LFeCl3/0.2mol/L CuCl2,完成下表的实验设计:
| 实验序号 | 双氧水体积/mL | 蒸馏水体积/mL | 添加的物质 |
| 1 | 10 | 0 | 4mLFeCl3 |
| 2 | 10 | 2 | 2mLCuCl2 |
②本实验需测定的数据是收集相同体积的氧气所需时间;
③A中装有10mL双氧水,未减少误差,加入其它物质的方法是连接分液漏斗前,直接加到锥形瓶中.
| A. | 用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液中一定不含K+ | |
| B. | 分液漏斗和容量瓶在使用前都要检漏 | |
| C. | 向某溶液中加人稀盐酸,产生的气体能使澄清石灰水变浑浊,该溶液一定是碳酸盐溶液 | |
| D. | 0.84g铁和50.00 mL 1.00 mol/L的稀硝酸反应,反应后溶液中一定只有Fe3+ |
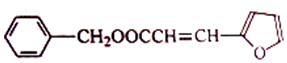 )的合成路线:
)的合成路线: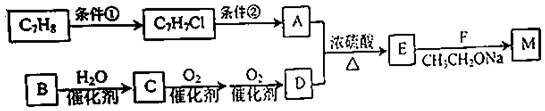
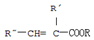
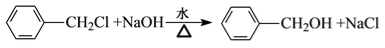 .A+D→E的反应类型为取代反应(酯化反应).
.A+D→E的反应类型为取代反应(酯化反应).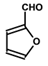 .
.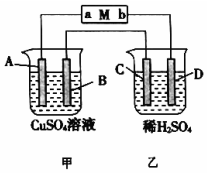 如图所示装置中,当线路接通时,发现M 滤纸(用Na2SO4溶液的石蕊试液浸润过)的a端显蓝色,b端显红色,且知甲中电极材料是锌、银,乙中电极材料是铂、铜,且乙中两电极不发生变化.回答:
如图所示装置中,当线路接通时,发现M 滤纸(用Na2SO4溶液的石蕊试液浸润过)的a端显蓝色,b端显红色,且知甲中电极材料是锌、银,乙中电极材料是铂、铜,且乙中两电极不发生变化.回答: