题目内容
6.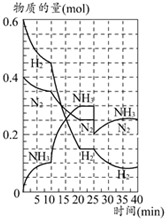 500℃时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3物质的量变化如图所示,分析图象完成下列问题:
500℃时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3物质的量变化如图所示,分析图象完成下列问题:①0~10分钟,N2的平均反应速率为0.0025mol•L-1•min-1
②反应在进行到10分种时,引起曲线陡变的原因是加入催化剂(填改变的条件)
③计算500℃时,反应N2+3H2$?_{高温高压}^{催化剂}$2NH3的平衡常数K的数值为426.7;保持温度不变,反应进行至25min时,抽去0.1mol氨,此时平衡常数K将不变(填“增大”“减小”或“不变”)
④在图中画出25~40min时间段内N2的物质的量的变化图象.
分析 ①根据v=$\frac{△c}{△t}$计算0-10分钟内v(N2);
②由图象可知各组分物质的量变化增快,且10min时是连续的,三种气体物质的速率增加倍数相同,说明为使用催化剂;
③平衡常数k=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2}){c}^{3}({H}_{2})}$,根据图求出平衡时各组分的物质的量浓度,代入计算;平衡常数只受温度影响,温度不变,平衡常数不变;
④抽去0.1mol氨,平衡向正反应进行,根据平衡时氢气的物质的量变化量△n(H2)计算出达新平衡时氮气的物质的量变化量△n(N2),进而计算氮气的物质的量,由此作图.
解答 解:①10分钟内以N2表示的平均反应速率v(N2)=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{0.4mol-0.35mol}{2L}}{10min}$=0.0025mol•L-1•min-1;
故答案为:0.0025;
②△n(H2)=0.025mol×12=0.3mol,△n(NH3)=0.025mol×8=0.2mol,物质的量变化之比等于化学计量数之比,三种气体物质的速率增加倍数相同,说明10min可能改变的条件是使用催化剂,而不是升高温度.
故答案为:加入催化剂;
③由图象可知,20min达平衡时,n(N2)=0.025mol×10=0.25mol,n(H2)=0.025mol×6=0.15mol,n(NH3)=0.025mol×12=0.3mol,所以平衡常数k=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2}){c}^{3}({H}_{2})}$=$\frac{(\frac{0.3mol}{2L})^{2}}{\frac{0.25mol}{2L}×(\frac{0.15mol}{2L})^{3}}$=426.7;
平衡常数只受温度影响,温度不变,平衡常数不变,所以抽去0.1mol氨,此时平衡常数K将不变数值为426.7;
故答案为:426.7;不变;
④由图可知,35min达平衡后△n(H2)=0.025mol×3=0.075mol,物质的量之比等于化学计量数之比,所以△n(N2)=$\frac{1}{3}$n(H2)=$\frac{1}{3}$×0.075mol=0.025mol,故图象为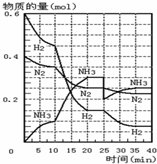
故答案为:
点评 本题考查反应速率、平衡常数、平衡移动及读图、作图能力,题目难度中等.易错点为作图要注意平衡时氮气的物质的量,不能仅比原平衡少.

| A. | 1.08mol•L-1 | B. | 1.37mol•L-1 | C. | 1.54mol•L-1 | D. | 2.48mol•L-1 |
| A. | 硫酸溶液与氢氧化钡溶液反应:Ba2++H++OH-+SO42-═BaSO4↓+H2O | |
| B. | AlCl3溶液中加入足量的氨水:Al3++3NH3•H2O══Al(OH)3↓+3NH4+ | |
| C. | Na与水反应:Na+H2O═Na++OH-+H2↑ | |
| D. | 碳酸钠与氢氧化钠:HCO3-+OH-═CO32-+H2O |
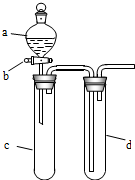 某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化.
某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化.(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c,其目的是检查装置气密性.
(2)下表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是丙.
| 方案 | 反应物 |
| 甲 | Cu、浓HNO3 |
| 乙 | Cu、稀HNO3 |
| 丙 | Cu、O2、稀HNO3 |
| A. | 标准状况下,22.4L SO3中含有的分子数为NA个 | |
| B. | 2L 0.5 mol•L-1亚硫酸溶液中含有的H+离子数为2NA | |
| C. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA | |
| D. | 密闭容器中2mol NO和1mol O2充分反应,产物的分子数为2NA |
| A. |  制乙酸乙酯 | B. |  制氢氧化亚铁 | C. |  石油的蒸馏 | D. |  实验室制乙烯 |
 中含氧官能团的结构简式是-CHO;该有机物发生加聚反应后,所得产物的结构简式为
中含氧官能团的结构简式是-CHO;该有机物发生加聚反应后,所得产物的结构简式为 .
.