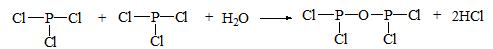题目内容
1.含有a mol FeBr2的溶液中,通入x mol Cl2.下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是( )| A. | x=0.4a,2Fe2++Cl2═2Fe3++2Cl- | |
| B. | x=0.6a,2Br-+Cl2═Br2+2Cl- | |
| C. | x=2a,2Fe2++2Br-+2Cl2═Br2+2Fe3++4Cl- | |
| D. | x=1.5a,2Fe2++4Br-+3Cl2═2Br2+2Fe3++6Cl- |
分析 Fe 2+ 的还原性比Br- 强,所以Cl 2 通入FeBr 2 溶液中,当Cl 2 不足量时,会先与Fe 2+ 反应;待Fe 2+ 全部被氧化成Fe 3+ 后,过量的Cl 2 才会与Br- 反应.
解答 解:由于还原性:Fe2+>Br-,通入Cl2,依次发生2Fe2++Cl2=2Fe3++2Cl-,2Br-+Cl2=Br2+2Cl-,
当n(Cl2):n(FeBr2)≤$\frac{1}{2}$时,只氧化Fe2+,当n(Cl2):n(FeBr2)≥$\frac{3}{2}$时,Fe2+和Br-被完全氧化,介于二者之间时,Fe2+被完全氧化,Br-被部分氧化,则
A.x=0.4a,n(Cl2):n(FeBr2)=0.4<$\frac{1}{2}$,只氧化Fe2+,故A正确;
B.x=0.6a,n(Cl2):n(FeBr2)介于$\frac{1}{2}$~$\frac{3}{2}$,Fe2+被完全氧化,Br-被部分氧化,故B错误;
C.x=2a,n(Cl2):n(FeBr2)≥$\frac{3}{2}$,Fe2+和Br-被完全氧化,则反应的离子方程式为2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl-,故C错误;
D.x=1.5a,Fe2+和Br-恰好被完全氧化,反应的离子方程式为2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl-,故D正确;
故选:BC.
点评 本题考查了离子方程式书写,侧重考查氧化还原反应离子方程式书写,明确氧化还原反应先后规律,熟悉溴离子、二价铁离子氧化性强弱关系是解题关键,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
12.氮是地球上含量丰富的一种元素,氮元素的单质及其化合物在工农业生产、生活中有着重要作用.
(1)根据下面能量变化示意图(图1),请写出 NO 和 CO2 反应的热化学方程式NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ•mol-1.

(2)在固定体积的密闭容器中,进行如下化学反应:2NH3(g)?N2(g)+3H2(g)△H>0,其平衡常数 K 与温度 T 的关系如表:
①试判断 K1<K2(填写“>”,“<”或“=”);
②该反应的熵变△S>0 (填“>”,“<”或“=”);
③下列各项能说明该反应已达到平衡状态的是c(填字母);
a.容器内 N2、H2、NH3 的物质的量之比为 1:3:2
b.2v(NH3)正=3v(H2)
c.容器内混合气体平均相对分子质量保持不变
d.混合气体的密度保持不变
④一定温度下,在 1L 密闭容器中充入 1molN2 和 3molH2 并发生反应.若容器容积恒 定,10min 达到平衡时,气体的总物质的量为原来的$\frac{9}{10}$,则 N2 的转化率 α(N2)=20%.
(3)在常温常压下 pH 均等于 5 的 CH3COOH 和 HCl 溶液,两种溶液中由水电离出来的c(H+)之比为1:1.
(4)对反应 N2O4(g)?2NO2(g)△H>0,在温度分别为 T1、T2时,平衡体 系中 NO2 的体积分数随压强变化曲线如图2所示,下列说法正确的是cd.
a.A、C 两点的反应速率:A>C
b.A、C 两点的化学平衡常数:A>C
c.A、C 两点 N2O4 的转化率:A>C
d.由状态 B 到状态 A,可以用加热的方法.
(1)根据下面能量变化示意图(图1),请写出 NO 和 CO2 反应的热化学方程式NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ•mol-1.

(2)在固定体积的密闭容器中,进行如下化学反应:2NH3(g)?N2(g)+3H2(g)△H>0,其平衡常数 K 与温度 T 的关系如表:
| T/K | 2.98 | 398 | 498 |
| 平衡常数K | 2.44×10-6 | K1 | K2 |
②该反应的熵变△S>0 (填“>”,“<”或“=”);
③下列各项能说明该反应已达到平衡状态的是c(填字母);
a.容器内 N2、H2、NH3 的物质的量之比为 1:3:2
b.2v(NH3)正=3v(H2)
c.容器内混合气体平均相对分子质量保持不变
d.混合气体的密度保持不变
④一定温度下,在 1L 密闭容器中充入 1molN2 和 3molH2 并发生反应.若容器容积恒 定,10min 达到平衡时,气体的总物质的量为原来的$\frac{9}{10}$,则 N2 的转化率 α(N2)=20%.
(3)在常温常压下 pH 均等于 5 的 CH3COOH 和 HCl 溶液,两种溶液中由水电离出来的c(H+)之比为1:1.
(4)对反应 N2O4(g)?2NO2(g)△H>0,在温度分别为 T1、T2时,平衡体 系中 NO2 的体积分数随压强变化曲线如图2所示,下列说法正确的是cd.
a.A、C 两点的反应速率:A>C
b.A、C 两点的化学平衡常数:A>C
c.A、C 两点 N2O4 的转化率:A>C
d.由状态 B 到状态 A,可以用加热的方法.
16.氢氧燃料电池已用于航天飞机,它是以铂作电极,H2SO4溶液作电解质,正极反应为:O2+4H++4e-=2H2O,负极反应为:2H2-4e-=4H+.下列叙述不正确的是( )
| A. | H2在负极发生氧化反应 | B. | 燃料电池的能量转化率可达100% | ||
| C. | 是一种高效、环境友好的发电装置 | D. | 供电时的总反应为:2H2+O2=2H2O |
13.下列事实能说明氨水是弱电解质的是( )
| A. | 氨水与氯化铝溶液反应产生氢氧化铝沉淀 | |
| B. | 用氨水做导电实验,灯泡很暗 | |
| C. | 0.1mol/L的氨水的pH<13 | |
| D. | 氯化铵溶液的pH<7 |
1.下列离子方程式书写正确是( )
| A. | 硫酸溶液与氢氧化钡溶液反应:Ba2++H++OH-+SO42-═BaSO4↓+H2O | |
| B. | AlCl3溶液中加入足量的氨水:Al3++3NH3•H2O══Al(OH)3↓+3NH4+ | |
| C. | Na与水反应:Na+H2O═Na++OH-+H2↑ | |
| D. | 碳酸钠与氢氧化钠:HCO3-+OH-═CO32-+H2O |
2.下列物质中,含有共价键的是( )
| A. | KCl | B. | CaO | C. | CO2 | D. | NaCl |