题目内容
5.利用石墨电极电解1mol/L氯化钠溶液,并收集阳极气体检验其成分.已知:O2能使酸性的淀粉KI溶液变蓝,不能使中性的淀粉KI溶液变蓝.
实验:①将气体通入中性的淀粉KI溶液中,溶液变蓝.
②用足量NaOH溶液充分洗气,气体体积减少,将剩余气体通入中性的淀粉KI溶液中,溶液颜色不变,再向溶液中滴加2滴H2SO4溶液,溶液变蓝.
③向酸性的淀粉KI溶液中通入空气,溶液颜色不变.
下列对实验现象的解释或推测不合理的是( )
| A. | NaOH溶液洗气时发生反应的离子方程式为:2OH-+Cl2=Cl-+ClO-+H2O | |
| B. | 根据实验可以得出中性条件下,氧化性Cl2>O2 | |
| C. | 根据实验可以得出反应物的浓度和溶液的pH会影响物质的氧化性 | |
| D. | 当电路中通过2mol电子时,阳极可收集到标准状况下气体体积为22.4L |
分析 A.由②用足量NaOH溶液充分洗气,气体体积减少,可知氯气与NaOH反应;
B.由③向酸性的淀粉KI溶液中通入空气,溶液颜色不变,可知氧气不能氧化KI,而①中氯气可氧化KI;
C.由实验①②③可知,浓度不同、酸碱性不同;
D.发生2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,阳极上阴离子放电生成氯气,但氯气与碱反应.
解答 解:A.由②用足量NaOH溶液充分洗气,气体体积减少,可知氯气与NaOH反应,洗气时发生反应的离子方程式为:2OH-+Cl2=Cl-+ClO-+H2O,故A正确;
B.由③向酸性的淀粉KI溶液中通入空气,溶液颜色不变,可知氧气不能氧化KI,而①中氯气可氧化KI,则中性条件下,氧化性Cl2>O2,故B正确;
C.由实验①②③可知,浓度不同、酸碱性不同,则反应物的浓度和溶液的pH会影响物质的氧化性,故C正确;
D.发生2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,阳极上阴离子放电生成氯气,但氯气与碱反应,则当电路中通过2mol电子时,阳极可收集到标准状况下气体体积小于22.4L,故D错误;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握实验操作和技能、电解反应及物质的性质为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
13.下列物质中,既能与盐酸反应,又能与氢氧化钠溶液反应的是( )
①NaHSO4②Al2O3 ③NaHSO3 ④(NH4)2CO3.
①NaHSO4②Al2O3 ③NaHSO3 ④(NH4)2CO3.
| A. | ②③④ | B. | ①②③④ | C. | ②③ | D. | ①②③ |
20.下列有关化学用语表示正确的是( )
| A. | N2的电子式: | B. | 氯原子的结构示意图为: | ||
| C. | MgCl2的形成过程: | D. | NH3的电子式: |
10.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 在水溶液中:H+、I-、NO3-、SiO32- | |
| B. | 饱和氯水中:Cl-、NO3-、Na+、SO32- | |
| C. | 饱和CO2溶液中:H+、NH4+、Al3+、SO42- | |
| D. | 加入金属铝产生H2的溶液中:NH4+、Na+、SO42-、CO32- |
15.表列出了元素周期表中6种短周期元素的有关数据.
根据表中信息回答下列问题(均使用化学用语填空):
(1)写出下列编号对应元素的符号:②P,③Li.
(2)表中元素的最高价氧化物对应的水化物中,酸性最强的物质与碱性最强的物质反应生成的盐的化学式为NaClO4.
(3)请写出①、②、④三种元素的简单氢化物的稳定性由强到弱的顺序HF>NH3>PH3.
(4)元素⑥所在的主族中,氢化物的还原性最强的是HI.
(放射性元素除外)
| 元素编号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 原子半径(nm) | 0.075 | 0.110 | 0.152 | 0.071 | 0.186 | 0.099 |
| 最高价态 | +5 | +5 | +1 | 0 | +1 | +7 |
| 最低价态 | -3 | -3 | 0 | -1 | 0 | -1 |
(1)写出下列编号对应元素的符号:②P,③Li.
(2)表中元素的最高价氧化物对应的水化物中,酸性最强的物质与碱性最强的物质反应生成的盐的化学式为NaClO4.
(3)请写出①、②、④三种元素的简单氢化物的稳定性由强到弱的顺序HF>NH3>PH3.
(4)元素⑥所在的主族中,氢化物的还原性最强的是HI.
(放射性元素除外)




 .
.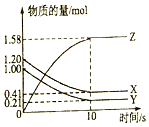 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示: