题目内容
20.下列有关化学用语表示正确的是( )| A. | N2的电子式: | B. | 氯原子的结构示意图为: | ||
| C. | MgCl2的形成过程: | D. | NH3的电子式: |
分析 A、氮气分子中存在氮氮三键,氮原子最外层为8电子;
B、氯原子的核内有17个质子,核外有17个电子;
C、氯化镁由2个氯离子和1个镁离子构成,相同离子不能合并;
D、NH3属于共价化合物,不存在离子键,分子中存在3对共用电子对,氮原子最外层为8个电子.
解答 解:A、氮气分子中存在氮氮三键,氮原子最外层为8电子,故N2的电子式为: ,故A正确;
,故A正确;
B、氯原子的核内有17个质子,核外有17个电子,故最外层有7个电子,即氯原子的结构示意图为 ,故B错误;
,故B错误;
C、MgCl2属于离子化合物,Mg最外层两个电子被两个Cl原子得到,用电子式表示形成过程为: ,故C错误;
,故C错误;
D、NH3属于共价化合物,不存在离子键,分子中存在3对共用电子对,氮原子最外层为8个电子,故NH3的电子式为: ,故D错误.
,故D错误.
故选A.
点评 本题考查用电子式表示物质形成过程和电子式书写,准确判断化合物类别及所含化学键类型是解题关键,题目难度不大.

练习册系列答案
相关题目
19.表为元素周期表的一部分用元素符号或化学式回答下列问题.
(1)写出⑥与⑦元素以原子个数1:2组成分子的电子式: ;
;
用电子式表示③与④两种元素对应化合物的形成过程: .
.
(2)①的气态氢化物与其最高价氧化物水化物反应的离子方程式为NH3+H+=NH4+,第三周期中除⑩元素以外离子半径最小的是Al3+(填离子符号).
(3)②③⑤三种元素最高价氧化物对应的水化物碱性最强的是KOH (填化学式),这三种碱性物质中有(填:“有”或“没有”)相互能发生的反应,若回答“有”,写出对应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O.
(4)元素⑧的单质与②⑨形成的化合物的溶液反应的离子方程式为Cl2+2Br-=2Cl-+Br2.在反应后的溶液中加入有机溶剂CCl4,震荡后静置的实验现象为溶液分层,下层为橙红色,上层为无色.
(5)与②同主族,第三周期的元素单质在⑦的单质中燃烧生成的化合物的电子式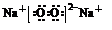 ;④⑧⑨元素的离子的还原性由强到弱顺序为Br->Cl->F-(用离子符号).
;④⑧⑨元素的离子的还原性由强到弱顺序为Br->Cl->F-(用离子符号).
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ① | ⑦ | ④ | ||||
| 3 | ③ | ⑤ | ⑧ | ⑩ | ||||
| 4 | ② | ⑨ |
 ;
;用电子式表示③与④两种元素对应化合物的形成过程:
 .
.(2)①的气态氢化物与其最高价氧化物水化物反应的离子方程式为NH3+H+=NH4+,第三周期中除⑩元素以外离子半径最小的是Al3+(填离子符号).
(3)②③⑤三种元素最高价氧化物对应的水化物碱性最强的是KOH (填化学式),这三种碱性物质中有(填:“有”或“没有”)相互能发生的反应,若回答“有”,写出对应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O.
(4)元素⑧的单质与②⑨形成的化合物的溶液反应的离子方程式为Cl2+2Br-=2Cl-+Br2.在反应后的溶液中加入有机溶剂CCl4,震荡后静置的实验现象为溶液分层,下层为橙红色,上层为无色.
(5)与②同主族,第三周期的元素单质在⑦的单质中燃烧生成的化合物的电子式
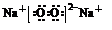 ;④⑧⑨元素的离子的还原性由强到弱顺序为Br->Cl->F-(用离子符号).
;④⑧⑨元素的离子的还原性由强到弱顺序为Br->Cl->F-(用离子符号).
8.下列物质既能与盐酸反应又能与NaOH溶液反应,并且都放出氢气的是( )
| A. | Fe | B. | Al | C. | Al2O3 | D. | Si |
15.下列有关原电池的叙述中正确的是( )
| A. | 在原电池的外电路中,电子由正极通过导线流向负极 | |
| B. | 在原电池的电解质溶液中,阳离子向负极移动 | |
| C. | 锌锰子电池是一种常用的一次性电池 | |
| D. | 氢氧燃料电池中氢气在负极发生氧化反应 |
5.利用石墨电极电解1mol/L氯化钠溶液,并收集阳极气体检验其成分.
已知:O2能使酸性的淀粉KI溶液变蓝,不能使中性的淀粉KI溶液变蓝.
实验:①将气体通入中性的淀粉KI溶液中,溶液变蓝.
②用足量NaOH溶液充分洗气,气体体积减少,将剩余气体通入中性的淀粉KI溶液中,溶液颜色不变,再向溶液中滴加2滴H2SO4溶液,溶液变蓝.
③向酸性的淀粉KI溶液中通入空气,溶液颜色不变.
下列对实验现象的解释或推测不合理的是( )
已知:O2能使酸性的淀粉KI溶液变蓝,不能使中性的淀粉KI溶液变蓝.
实验:①将气体通入中性的淀粉KI溶液中,溶液变蓝.
②用足量NaOH溶液充分洗气,气体体积减少,将剩余气体通入中性的淀粉KI溶液中,溶液颜色不变,再向溶液中滴加2滴H2SO4溶液,溶液变蓝.
③向酸性的淀粉KI溶液中通入空气,溶液颜色不变.
下列对实验现象的解释或推测不合理的是( )
| A. | NaOH溶液洗气时发生反应的离子方程式为:2OH-+Cl2=Cl-+ClO-+H2O | |
| B. | 根据实验可以得出中性条件下,氧化性Cl2>O2 | |
| C. | 根据实验可以得出反应物的浓度和溶液的pH会影响物质的氧化性 | |
| D. | 当电路中通过2mol电子时,阳极可收集到标准状况下气体体积为22.4L |
12.下列说法错误的是( )
| A. | 电子排布式(21Sc)1s22s22p63s23p63d3违反了能量最低原则 | |
| B. | 6C的电子排布式1s22s22p${\;}_{x}^{\;}$2违反了洪特规则 | |
| C. | ns电子的能量不一定高于(n-1)p电子的能量 | |
| D. | 电子排布式(22Ti)1s22s22p63s23p10违反了泡利原理 |
10.下列反应中生成物总能量高于反应物总能量的是( )
| A. | 碳酸钙受热分解 | B. | 乙醇燃烧 | C. | 钠与水的反应 | D. | 铝热反应 |
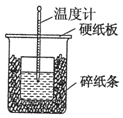 50mL 0.55mol•L-1盐酸与50mL 0.50mol•L-1NaOH溶液在如图的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.55mol•L-1盐酸与50mL 0.50mol•L-1NaOH溶液在如图的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: .
.