题目内容
15.表列出了元素周期表中6种短周期元素的有关数据.| 元素编号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 原子半径(nm) | 0.075 | 0.110 | 0.152 | 0.071 | 0.186 | 0.099 |
| 最高价态 | +5 | +5 | +1 | 0 | +1 | +7 |
| 最低价态 | -3 | -3 | 0 | -1 | 0 | -1 |
(1)写出下列编号对应元素的符号:②P,③Li.
(2)表中元素的最高价氧化物对应的水化物中,酸性最强的物质与碱性最强的物质反应生成的盐的化学式为NaClO4.
(3)请写出①、②、④三种元素的简单氢化物的稳定性由强到弱的顺序HF>NH3>PH3.
(4)元素⑥所在的主族中,氢化物的还原性最强的是HI.
(放射性元素除外)
分析 短周期元素中,①②都有+5、-3价,处于ⅤA族,原子半径①<②,则①为N,②为P;④⑥都有-1价,但⑥有+7价,且其原子半径较大,则④为F、⑥为Cl;③⑤都有最高价+1,原子半径③<⑤,则③为Li、⑤为Na,据此进行解答.
解答 解:短周期元素中,①②都有+5、-3价,处于ⅤA族,原子半径①<②,则①为N,②为P;④⑥都有-1价,但⑥有+7价,且其原子半径较大,则④为F、⑥为Cl;③⑤都有最高价+1,原子半径③<⑤,则③为Li、⑤为Na,
(1)根据分析可知,②为P元素,③为Li元素,
故答案为:P;Li;
(2)表中元素的最高价氧化物对应的水化物中,酸性最强的物质为高氯酸,碱性最强的物质为NaOH,二者反应生成的盐为:NaClO4,
故答案为:NaClO4;
(3)非金属性越强,对应氢化物的稳定性越强,非金属性:F>N>P,则氢化物稳定性:HF>NH3>PH3,
故答案为:HF>NH3>PH3;
(4)⑥所在的主族卤族,非金属性越弱,氢化物的还原性越强,则氢化物的还原性最强的是HI,
故答案为:HI.
点评 本题考查结构性质位置关系应用,题目难度中等,根据化合价与原子半径推断元素为解答关键,注意理解掌握元素周期律内容、元素周期表结构.

练习册系列答案
相关题目
5.利用石墨电极电解1mol/L氯化钠溶液,并收集阳极气体检验其成分.
已知:O2能使酸性的淀粉KI溶液变蓝,不能使中性的淀粉KI溶液变蓝.
实验:①将气体通入中性的淀粉KI溶液中,溶液变蓝.
②用足量NaOH溶液充分洗气,气体体积减少,将剩余气体通入中性的淀粉KI溶液中,溶液颜色不变,再向溶液中滴加2滴H2SO4溶液,溶液变蓝.
③向酸性的淀粉KI溶液中通入空气,溶液颜色不变.
下列对实验现象的解释或推测不合理的是( )
已知:O2能使酸性的淀粉KI溶液变蓝,不能使中性的淀粉KI溶液变蓝.
实验:①将气体通入中性的淀粉KI溶液中,溶液变蓝.
②用足量NaOH溶液充分洗气,气体体积减少,将剩余气体通入中性的淀粉KI溶液中,溶液颜色不变,再向溶液中滴加2滴H2SO4溶液,溶液变蓝.
③向酸性的淀粉KI溶液中通入空气,溶液颜色不变.
下列对实验现象的解释或推测不合理的是( )
| A. | NaOH溶液洗气时发生反应的离子方程式为:2OH-+Cl2=Cl-+ClO-+H2O | |
| B. | 根据实验可以得出中性条件下,氧化性Cl2>O2 | |
| C. | 根据实验可以得出反应物的浓度和溶液的pH会影响物质的氧化性 | |
| D. | 当电路中通过2mol电子时,阳极可收集到标准状况下气体体积为22.4L |
6.I.一定量的CO(g)和H2O(g)分别通入容积为1L的恒容密闭容器中,发生反应CO(g)+H2O?CO2(g)+H2(g)得到如下三组数据:
(1)下列情况表明反应达到平衡状态的是C (填序号)
A.CO2和H2生成速率相等
B.温度不变时,压强不变
C.生成CO2的速率和生成CO的速率相等
(2)实验2中,反应达到平衡状态时,CO的转化率为20%.
(3)实验3和实验2相比,改变的条件是加催化剂.
II.(1)硫化钠溶液具有较强碱性,其原因是S2-+H2O?HS-+OH-,HS-+H2O?H2S+OH-(用离子方程式表示).
(2)欲使0.1mol的Na2S溶液中,$\frac{c(H{S}^{-})}{c({S}^{2-})}$的值增大,可采取的措施是BC(填序号)
A.加适量等浓度的NaOH溶液
B.加适量的水
C.通入适量的H2S气体.
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衝所需时间/min | ||
| CO | H2O | CO2 | ||||
| 1 | 500 | 8 | 4 | 3.2 | 4 | |
| 2 | 700 | 4 | 2 | 0.8 | 3 | |
| 3 | 700 | 4 | 2 | 0.8 | 1 | |
A.CO2和H2生成速率相等
B.温度不变时,压强不变
C.生成CO2的速率和生成CO的速率相等
(2)实验2中,反应达到平衡状态时,CO的转化率为20%.
(3)实验3和实验2相比,改变的条件是加催化剂.
II.(1)硫化钠溶液具有较强碱性,其原因是S2-+H2O?HS-+OH-,HS-+H2O?H2S+OH-(用离子方程式表示).
(2)欲使0.1mol的Na2S溶液中,$\frac{c(H{S}^{-})}{c({S}^{2-})}$的值增大,可采取的措施是BC(填序号)
A.加适量等浓度的NaOH溶液
B.加适量的水
C.通入适量的H2S气体.
3.下列的实验操作、现象与解释均正确的是( )
| 编号 | 实验操作 | 实验现象 | 解释 |
| A | 将铜粉加入1.0mol/LFe(SO4)3溶液中 | 溶液变蓝 | 金属铁比铜活泼 |
| B | 将在Na2SiO3稀溶液中浸泡过的小木条立即置于酒精灯外焰 | 小木条不易燃烧 | Na2SiO3溶液有阻燃的作用 |
| C | 向NaBr溶液中滴加氯水 | 溶液颜色变成橙黄色 | 氯水中含有HClO |
| D | 将一小块金属钠放置于坩埚里加热 | 钠块先融化成小球,再燃烧 | 钠的熔点比钠的着火点低 |
| A. | A | B. | B | C. | C | D. | D |
10.下列反应中生成物总能量高于反应物总能量的是( )
| A. | 碳酸钙受热分解 | B. | 乙醇燃烧 | C. | 钠与水的反应 | D. | 铝热反应 |
20.下列实验操作可以达到目的是( )
| 目的 | 操作 | |
| A | 提纯含有少量乙酸的乙酸乙酯 | 向含有少量乙酸的乙酸乙酯中加入过量饱和碳酸钠溶液,振荡后静置分液,并除去有机相的水 |
| B | 检验溴乙烷中的溴元素 | 取样,加NaOH溶液,振荡后再加AgNO3溶液 |
| C | 提纯含有少量苯酚的苯 | 向含有少量苯酚的苯中加入过量的浓溴水振荡后静置过滤,除去三溴苯酚沉淀 |
| D | 检验蔗糖是否水解 | 蔗糖溶液在稀硫酸存在下水浴加热一段时间后,再与银氨溶液混合加热,观察现象 |
| A. | A | B. | B | C. | C | D. | D |
7.下列关于原子结构、元素性质的说法正确的是( )
| A. | 非金属元素组成的化合物中只含共价键 | |
| B. | ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强 | |
| C. | 同种元素的原子均有相同的质子数和中子数 | |
| D. | IA族金属元素是同周期中金属性最强的元素 |
4.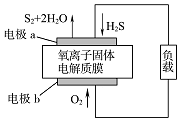 新华网报道:我国固体氧化物燃料电池技术研发取得新突破.科学家利用该技术实现了H2S废气资源回收能量,并得到单质硫的原理如图所示.下列说法正确的是( )
新华网报道:我国固体氧化物燃料电池技术研发取得新突破.科学家利用该技术实现了H2S废气资源回收能量,并得到单质硫的原理如图所示.下列说法正确的是( )
 新华网报道:我国固体氧化物燃料电池技术研发取得新突破.科学家利用该技术实现了H2S废气资源回收能量,并得到单质硫的原理如图所示.下列说法正确的是( )
新华网报道:我国固体氧化物燃料电池技术研发取得新突破.科学家利用该技术实现了H2S废气资源回收能量,并得到单质硫的原理如图所示.下列说法正确的是( )| A. | 电极b为电池的负极 | |
| B. | 电路中每流过4 mol电子,正极消耗44.8 L H2S | |
| C. | 电极b上的电极反应为:O2+4e-+4H+═2H2O | |
| D. | 电极a上的电极反应为:2H2S+2O2--4e-═S2+2H2O |
15.某温度时,VIA元素单质与H2反应生成气态H2X的热化学方程式如下:
$\frac{1}{2}$O2(g)+H2(g)═H2O(g)△H=-242kJ•mol-1
S(g)+H2(g)═H2S(g)△H=-20kJ•mol-1
Se(g)+H2(g)?H2Se(g)△H=+81kJ•mol-1
下列说法正确的是( )
$\frac{1}{2}$O2(g)+H2(g)═H2O(g)△H=-242kJ•mol-1
S(g)+H2(g)═H2S(g)△H=-20kJ•mol-1
Se(g)+H2(g)?H2Se(g)△H=+81kJ•mol-1
下列说法正确的是( )
| A. | 稳定性:H2O<H2S<H2Se | |
| B. | 降温有利于Se与H2反应生成H2Se | |
| C. | O2(g)+2H2S(g)═2H2O(g)+2S(g)△H=-444 kJ•mol-1 | |
| D. | 随着核电荷数的增加,VIA族元素单质与H2的化合反应越容易发生 |