题目内容
8.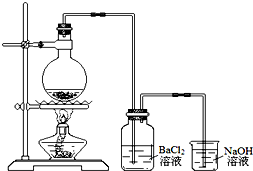 某学习小组探究铜跟浓硫酸反应的情况.取6.4g铜片和10mL 18mol•L-1的浓硫酸放在圆底烧瓶中,按如图所示装置进行实验.
某学习小组探究铜跟浓硫酸反应的情况.取6.4g铜片和10mL 18mol•L-1的浓硫酸放在圆底烧瓶中,按如图所示装置进行实验.(1)铜和浓硫酸反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)实验结束后,发现广口瓶中产生白色沉淀,加入足量盐酸后沉淀几乎完全溶解.简要分析广口瓶中产生沉淀的主要原因:烧杯中的溶液倒吸入广口瓶中,与BaCl2溶液反应生成BaSO3沉淀.
(3)实验结束后,发现烧瓶中有铜片剩余.根据所学知识,他们认为烧瓶中还有较多的硫酸剩余.选择合适的试剂,设计简单易行的实验方案证明有余酸:取少量余液于试管中,加入足量Fe粉(或Na2CO3溶液),有气体产生证明有余酸.
供选择的试剂:铁粉、银粉、BaCl2溶液、Na2CO3溶液
(4)甲同学设计如下方案:测定产生气体的量,再计算余酸的浓度.下列测定产生气体的量的实验方法中,不可行的是abc(填编号).
a.将气体缓缓通过预先称量、盛有碱石灰的干燥管,反应结束后再次称量
b.将气体通入硫酸酸化的KMnO4溶液,再加足量BaCl2溶液,过滤、洗涤、干燥,称量沉淀
c.用排水法测定产生气体的体积
d.用排饱和NaHSO3的方法测定产生气体的体积
(5)乙同学设计通过酸碱中和滴定来测定余酸的浓度:待烧瓶冷却至室温后,将其中的溶液用蒸馏水稀释至100mL,移取25mL到锥形瓶中,滴加2滴酚酞试液,用标准NaOH溶液滴至终点.平行实验三次.
①稀释时,应先往烧杯(填仪器名称)中加入蒸馏水(填“烧瓶中的溶液”或“蒸馏水”).
②该方法测得的余酸浓度偏大(填“偏大”、“偏小”或“准确”).
(6)丙设计了测定余酸浓度的较为简易的实验方案:取出反应后剩余的铜片,进行洗涤、干燥、称量.若称得剩余铜片的质量为3.2g,反应后溶液体积变化忽略不计,则剩余硫酸的物质的量浓度为8mol/L.
分析 (1)铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫气体和水;
(2)二氧化硫不与二氧化硫反应,但是二氧化硫容易与氢氧化钠溶液反应生成亚硫酸钠,若发生倒吸现象,则亚硫酸钠与钡离子反应生成亚硫酸钡沉淀;
(3)证明硫酸有剩余,需要证明反应后的溶液中含有大量氢离子,据此设计实验方案;
(4)碱石灰能吸收二氧化硫和水;硫酸酸化高锰酸钾后,影响了二氧化硫的测定;二氧化硫易溶于水,不能使用排水法测量气体体积,据此进行判断;
(5)①稀释浓硫酸时,应该将浓硫酸加入蒸馏水中;
②酚酞的变色范围为8-10,所以滴定终点时溶液的pH=8,则加入的氢氧化钠溶液比剩余溶液中氢离子的物质的量大,测定结果偏大;
(6)根据反应方程式可知,反应消耗的硫酸的物质的量是铜的2倍,据此可以计算出消耗的硫酸的浓度及剩余硫酸的物质的量浓度.
解答 解:(1)铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫气体和水,则铜与浓硫酸反应的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)由于氯化钡不与二氧化硫反应,若生成了白色沉淀,该白色沉淀只能为亚硫酸钡,说明烧杯中的溶液倒吸入广口瓶中,亚硫酸钠与BaCl2溶液反应生成BaSO3沉淀,
故答案为:烧杯中的溶液倒吸入广口瓶中,与BaCl2溶液反应生成BaSO3沉淀;
(3)实验结束后,发现烧瓶中有铜片剩余,由于稀硫酸不与铜反应,则烧瓶中还有较多的硫酸剩余,证明硫酸有剩余,需要证明反应后的溶液中含有大量氢离子,可以用金属铁或碳酸钠溶液检验,方法为:取少量余液于试管中,加入足量Fe粉(或Na2CO3溶液),有气体产生证明有余酸,
故答案为:取少量余液于试管中,加入足量Fe粉(或Na2CO3溶液),有气体产生证明有余酸;
(4)a.将装置产生的气体缓缓通过预先称量过盛有碱石灰的干燥管,结束反应后再次称量,由于气体中含有水蒸气,碱石灰会吸收二氧化硫和水蒸气,称量后计算不准确,故a错误;
b.将气体通入硫酸酸化的KMnO4溶液,由于硫酸能够与氯化钡反应生成硫酸钡,干扰了二氧化硫的测定,所以不能用硫酸酸化高锰酸钾溶液,故b错误;
c.二氧化硫易溶于水,测量出的二氧化硫不准确,故c错误;
d.用排饱和NaHSO3溶液的方法测出装置A产生气体的体积,二氧化硫在饱和NaHSO3溶液中的溶解度降低,可以用排水量气方法进行二氧化硫的气体体积测定,故d正确;
故答案为:abc;
(5)①浓硫酸密度大于水,稀释时放出大量热,所以稀释时,应先往烧杯中加入蒸馏水,然后再慢慢加入反应后烧杯中的溶液,
故答案为:烧杯;蒸馏水;
②用酚酞做指示剂,溶液变色时的pH=8>7,则滴定终点时加入的氢氧化钠稍过量,导致测定结果偏大,
故答案为:偏大;
(6)反应的铜的物质的量为:n(Cu)=$\frac{6.4g-3.2g}{64g/mol}$=0.05mol,
根据反应Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O可知,反应消耗的硫酸的物质的量是铜的2倍,则反应消耗的硫酸的物质的量为:0.05mol×2=0.1mol,
则反应消耗的硫酸的浓度为:$\frac{0.1mol}{0.01L}$=10mol/L,
所以反应后剩余硫酸的浓度为:18mol/L-10mol/L=8mol/L,
故答案为:8mol/L.
点评 本题考查了浓硫酸的化学性质、性质实验方案的设计,题目难度中等,明确实验目的为解答关键,注意掌握性质实验方案的设计原则及浓硫酸的性质,试题侧重考查学生的分析及化学实验、化学计算能力.

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案| 元素编号 | 元素性质或原子结构 |
| T | M层上有2对成对电子 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物的水溶液显碱性 |
| Z | 短周期元素最高正化合价是+7价 |
| W | 3d能级电子数是最外层电子数的3倍 |
 .
.(2)元素Y的价电子排布式为2s22p3,元素Y与元素T相比,电负性较大的是N(用元素符号表示).元素Y的第一电离能>氧的第一电离能(填“>”“=”或“<”)
(3)元素Z与元素T相比,非金属性强的是Cl(用元素符号表示),下列表述中能证明这一事实的是bd.
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
d.最高价氧化物对应水化物的酸性Z的比T的酸性强
(4)W的电子排布式为1s22s22p63s23p63d64s2,稳定性比较:W3+>W2+(“>”或“<”),原因是Fe3+最外层为半充满结构.

| 分子式 | C16H14O2 |
| 部分性质 | 能使Br2/CCl4褪色 |
| 能在稀H2SO4中水解 |
(2)由甲转化为乙需经如图2过程(已略去各步反应的无关产物,下同):其中反应Ⅰ的反应类型为加成,反应Ⅱ的化学方程式为
 .
. | A. | [Cl-]>[NH4+]>[H+]>[OH-] | B. | [Cl-]>[H+]>[NH4+]>[OH-] | C. | [NH4+]>[OH-]>[Cl-]>[H+] | D. | [OH-]>[H+]>[Cl-]>[NH4+] |
| A. | 增加C的量 | |
| B. | 将容器的体积缩小一半 | |
| C. | 保持体积不变,充入一定量的H2O(g) | |
| D. | 保持压强不变,充入N2使容器体积变大 |
| A. | 标准状况下,22.4L H2O含有NA个分子 | |
| B. | 1L 1mol•L -1的NaClO 溶液中含有ClO-的数目少于NA个 | |
| C. | 0.1molAlCl3完全转化为氢氧化铝胶体,生成0.l NA个胶体粒子 | |
| D. | 0.1molCl2与足量NaOH溶液反应,转移电子数为0.2 NA |
甲:用pH试纸测定0.1moI/L HA溶液的pH,即可证明HA是弱电解质.
乙:①分别取pH=l的HA溶液和稀盐酸各10.00mL,再加水稀释为100mL:
②各取相同体积的两种稀释液(适量),同时分别加入纯度和形状大小均相同的锌粒(足量),观察现象,即可证明HA是弱电解质.
丙:将适量的HA溶液和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,分析表中数据可以说明HA是弱电解质.
| 编号 | NaOH/mol•L-1 | HA/mol•L-1 | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.1 | 0.2 | pH<7 |
(2)在乙的方案的第①步中,需要用到的定量仪器是酸式滴定管.pH均为1的HA溶液和稀盐酸中,水的电离程度的大小关系是c(填字母).
a.HA溶液中水的电离程度大
b.稀盐酸中水的电离程度大
c.两种溶液中水的电离程度相同
(3)乙的方案中,说明HA是弱电解质的主要现象是B(填字母).
A.装稀盐酸的试管中放出H2的速率快
B.装HA溶液的试管中放出H2的速率快
C.两个试管中产生气体的速率一样快
(4)丙的方案中,编号②中的c>(填“>”、“<”或“=”)0.l,该混合液中的离子浓度:c(Na+)=(填“>”、“<”或“=”)c(A-).
(5)丙的方案中,编号③的数据表明,混合溶液中HA的电离程度比NaA的水解程度:强(填“强”、“弱”或“无法确定”).
| A. | pH=1的溶液中:Na+、K+、SO32-、MnO4- | |
| B. | pH=7的溶液中:Na+、Al3+、Cl-、SO42- | |
| C. | pH>12的溶液中:Na+、K+、SO42-、AlO2- | |
| D. | pH=0的溶液中:Na+、K+、NO3-、ClO- |
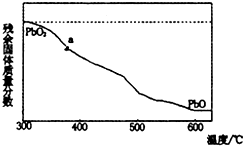 (1)某小组分析二氧化铅分解产物的组成,取478g的PbO2加热,PbO2在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a为96.66%,则a点固体的分子式为Pb2O3
(1)某小组分析二氧化铅分解产物的组成,取478g的PbO2加热,PbO2在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a为96.66%,则a点固体的分子式为Pb2O3