题目内容
16.已知某溶液中存在OH-、H+、NH4+、Cl- 四种离子,经四位同学测定其浓度大小的关系如下,其中不可能正确的是( )| A. | [Cl-]>[NH4+]>[H+]>[OH-] | B. | [Cl-]>[H+]>[NH4+]>[OH-] | C. | [NH4+]>[OH-]>[Cl-]>[H+] | D. | [OH-]>[H+]>[Cl-]>[NH4+] |
分析 A.若为NH4Cl溶液,NH4+离子水解溶液呈酸性,水解程度很小,则符合;
B.若为NH4Cl、HCl混合溶液,HCl浓度远大于NH4Cl浓度,则符合;
C.若为氨水和盐酸的混合液,且氨水浓度过量,可以满足该离子浓度关系;
D.任何电中性溶液,都必须遵循电荷守恒,根据电荷守恒判断.
解答 解:A、若为NH4Cl溶液,NH4+离子水解溶液呈酸性,水解程度很小,溶液中离子浓度大小为:[Cl-]>[NH4+]>[H+]>[OH-],故A正确;
B.若为NH4Cl、HCl混合溶液,HCl浓度远大于NH4Cl浓度,溶液中离子浓度大小为:[Cl-]>[H+]>[NH4+]>[OH-],故B正确;
C.若为氨水和盐酸的混合液,且氨水浓度较大时,溶液中可以满足:[NH4+]>[OH-]>[Cl-]>[H+],故C正确;
任何电中性溶液,都必须遵循电荷守恒,即:c(Cl-)+c(OH-)=c(H+)+c(NH4+),显然在两对阴、阳离子浓度比较中,结果不可能相同,即不可能有:c(Cl-)>c(NH4+)、c(OH-)>c(H+),故C错误;
D.任何电中性溶液,都必须遵循电荷守恒,离子浓度[OH-]>[H+]>[Cl-]>[NH4+]违反了电荷守恒,故D错误;
故选D.
点评 本题考查离子浓度大小比较,难度中等,离子浓度大小比较,通常考虑电解质电离、盐类水解、水的电离、电荷守恒、物料守恒、质子恒等式等,注意水解程度很小,弱电解质电离程度不大.

练习册系列答案
相关题目
6.某化学兴趣小组设计如图1流程,从酸性工业废液(含H+、Al3+、Mg2+、Cr3+、SO42-)中提取铬.
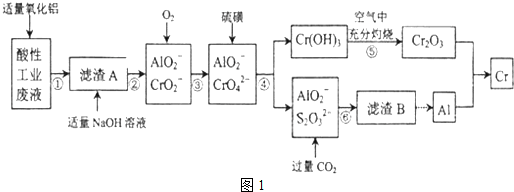
有关数据如表:
回答下列问题:
(1)步骤①所得滤液可用于制取MgSO4•7H2O,酸性工业废液中加入适量氧化铝的作用是调节溶液的pH.
(2)若酸性废液中c(Mg2+)=0.1mol/L,为达到步骤①的实验目的,则废液的pH应保持在(5.3,7.8)范围(保留小数点后l位).
(3)步骤②中生成NaCrO2 的离子方程式为Cr(OH)3+OH-=CrO2-+2H2O.
(4)步骤④中反应的离子方程式为7H2O+4CrO42-+6S=4Cr(OH)3↓+3S2O32-+2OH-.
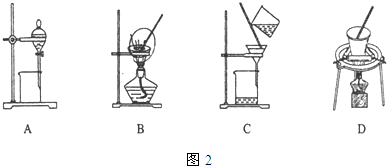
(5)步骤⑤在空气中充分灼烧的目的是使Cr(OH)3完全转化为Cr2O3,可选用的装置是图2中的D.(填序号)
(6)步骤⑦中发生的化学反应方程式为Cr2O3+2Al$\frac{\underline{\;\;△\;\;}}{\;}$2Cr+Al2O3.

有关数据如表:
| 化合物 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| 完全沉淀的PH | 10.5 | 4.3 | 5.3 |
| 开始溶解的pH | -- | 7.8 | 9.2 |
| Ksp近似值 | 10-12 | 10-14 | 10-31 |
(1)步骤①所得滤液可用于制取MgSO4•7H2O,酸性工业废液中加入适量氧化铝的作用是调节溶液的pH.
(2)若酸性废液中c(Mg2+)=0.1mol/L,为达到步骤①的实验目的,则废液的pH应保持在(5.3,7.8)范围(保留小数点后l位).
(3)步骤②中生成NaCrO2 的离子方程式为Cr(OH)3+OH-=CrO2-+2H2O.
(4)步骤④中反应的离子方程式为7H2O+4CrO42-+6S=4Cr(OH)3↓+3S2O32-+2OH-.
(5)步骤⑤在空气中充分灼烧的目的是使Cr(OH)3完全转化为Cr2O3,可选用的装置是图2中的D.(填序号)

(6)步骤⑦中发生的化学反应方程式为Cr2O3+2Al$\frac{\underline{\;\;△\;\;}}{\;}$2Cr+Al2O3.
7.下列有关溶液中粒子浓度的关系式中,正确的是( )
| A. | pH相同的①CH3COONa、②NaHCO3、③C6H5ONa,三份溶液中的c(Na+):③>②>① | |
| B. | 0.1mol•L-1某二元弱酸强碱盐NaHA溶液中:c(Na+)═2c(A2-)+c(HA-)+c(H2A) | |
| C. | 在电解食盐水的实验中,若电解后溶液总体积为1L,阴极析出的气体的分子数为0.5NA,电解后溶液的pH为12 | |
| D. | 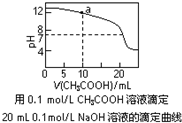 如图中a点溶液中各离子浓度的关系是:c(OH-)═c(H+)+c(CH3COO-)+2c(CH3COOH) |
4.把0.02 mol/LCH3COOH溶液和0.01 mol/L NaOH溶液以等体积混合,则混合液中粒子浓度关系正确的为( )
| A. | c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-) | B. | c(HAc)>c(CH3COO-) | ||
| C. | 2c(H+)=c(CH3COO-)-c(CH3COOH) | D. | c(CH3COOH)+c(CH3COO-)=0.02mol/L |
5.在一定温度下,可逆反应A(g)+3B(g)?2C(g)达到平衡的标志是( )
| A. | C生成的速率与C分解的速率不相等 | |
| B. | A、B、C的浓度不再变化 | |
| C. | 单位时间生成nmolA,同时生成3nmolB | |
| D. | A、B、C的分子数之比为1:3:2 |
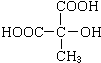 .
.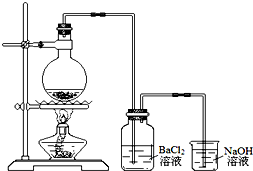 某学习小组探究铜跟浓硫酸反应的情况.取6.4g铜片和10mL 18mol•L-1的浓硫酸放在圆底烧瓶中,按如图所示装置进行实验.
某学习小组探究铜跟浓硫酸反应的情况.取6.4g铜片和10mL 18mol•L-1的浓硫酸放在圆底烧瓶中,按如图所示装置进行实验.