题目内容
18.现有部分元素的性质或原子结构信息如表,据此回答下列问题:| 元素编号 | 元素性质或原子结构 |
| T | M层上有2对成对电子 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物的水溶液显碱性 |
| Z | 短周期元素最高正化合价是+7价 |
| W | 3d能级电子数是最外层电子数的3倍 |
 .
.(2)元素Y的价电子排布式为2s22p3,元素Y与元素T相比,电负性较大的是N(用元素符号表示).元素Y的第一电离能>氧的第一电离能(填“>”“=”或“<”)
(3)元素Z与元素T相比,非金属性强的是Cl(用元素符号表示),下列表述中能证明这一事实的是bd.
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
d.最高价氧化物对应水化物的酸性Z的比T的酸性强
(4)W的电子排布式为1s22s22p63s23p63d64s2,稳定性比较:W3+>W2+(“>”或“<”),原因是Fe3+最外层为半充满结构.
分析 T原子的M层上有2对成对电子,则M层电子排布为3s23p4,T元素最外层共有6个电子,原子核外应有16个电子,则T为S元素;
X最外层电子数是次外层的两倍,因此X次外层为2个电子,最外层为4个电子,则X为C元素;
Y单质是双原子分子,且其氢化物水溶液显碱性,可知Y为N元素;
元素Z最高正价是+7价,由于F没有正化合价,Z为短周期元素,则Z为Cl元素,
W3d能级电子数是最外层电子数的3倍,应为3d64s2,为Fe元素,以此解答该题.
解答 解;T原子的M层上有2对成对电子,则M层电子排布为3s23p4,T元素最外层共有6个电子,原子核外应有16个电子,则T为S元素;
X最外层电子数是次外层的两倍,因此X次外层为2个电子,最外层为4个电子,则X为C元素;
Y单质是双原子分子,且其氢化物水溶液显碱性,可知Y为N元素;
元素Z最高正价是+7价,由于F没有正化合价,Z为短周期元素,则Z为Cl元素,
W3d能级电子数是最外层电子数的3倍,应为3d64s2,为Fe元素,
(1)X为C原子核外有6个电子,运动状态各不相同,元素X与H元素形成的化合物是当今重要的能源,为甲烷,电子式为 ,
,
故答案为:6; ;
;
(2)元素N的价电子排布式为2s22p3,N的电负性比S强,由于N的最外层为半充满结构,第一电离能大于O,
故答案为:2s22p3;N;>;
(3)是、Cl位于同周期,Cl的非金属性较强,元素的非金属性越强,对应的氢化物越稳定,对应的最高价氧化物对应水化物的酸性越强,bd可用于比较,
故答案为:Cl;bd;
(4)Fe元素为26号元素,则核外有26个电子,所以核外电子排布式为:1s22s22p63s23p63d64s2,因为Fe3+最外层为半充满结构,难以失去电子,所以化学稳定性:Fe2+<Fe3+,
故答案为:1s22s22p63s23p63d64s2;>;Fe3+最外层为半充满结构.
点评 本题考查了位置结构与性质的关系,为高频考点,题目难度中等,试题侧重于学生的分析能力的考查,正确推断各元素名称为解答关键,注意把握原子的结构特点.

| A. | Cl2是一种黄绿色、有刺激性气味、有毒的气体 | |
| B. | Cl2能使湿润的红色布条褪色 | |
| C. | Fe在Cl2中燃烧,生成的产物为FeCl2 | |
| D. | 实验室用加热二氧化锰和浓盐酸的方法制取Cl2 |
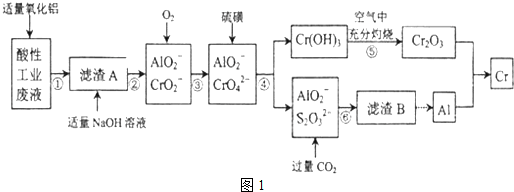
有关数据如表:
| 化合物 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| 完全沉淀的PH | 10.5 | 4.3 | 5.3 |
| 开始溶解的pH | -- | 7.8 | 9.2 |
| Ksp近似值 | 10-12 | 10-14 | 10-31 |
(1)步骤①所得滤液可用于制取MgSO4•7H2O,酸性工业废液中加入适量氧化铝的作用是调节溶液的pH.
(2)若酸性废液中c(Mg2+)=0.1mol/L,为达到步骤①的实验目的,则废液的pH应保持在(5.3,7.8)范围(保留小数点后l位).
(3)步骤②中生成NaCrO2 的离子方程式为Cr(OH)3+OH-=CrO2-+2H2O.
(4)步骤④中反应的离子方程式为7H2O+4CrO42-+6S=4Cr(OH)3↓+3S2O32-+2OH-.
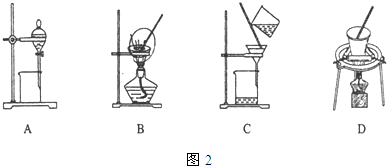
(5)步骤⑤在空气中充分灼烧的目的是使Cr(OH)3完全转化为Cr2O3,可选用的装置是图2中的D.(填序号)
(6)步骤⑦中发生的化学反应方程式为Cr2O3+2Al$\frac{\underline{\;\;△\;\;}}{\;}$2Cr+Al2O3.
| A. | 2VL | B. | VL | C. | 0.5VL | D. | 无法计算 |
| A. | 1:1 | B. | 1:2 | C. | 3:1 | D. | 1:3 |
| A. | pH相同的①CH3COONa、②NaHCO3、③C6H5ONa,三份溶液中的c(Na+):③>②>① | |
| B. | 0.1mol•L-1某二元弱酸强碱盐NaHA溶液中:c(Na+)═2c(A2-)+c(HA-)+c(H2A) | |
| C. | 在电解食盐水的实验中,若电解后溶液总体积为1L,阴极析出的气体的分子数为0.5NA,电解后溶液的pH为12 | |
| D. | 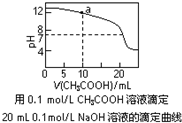 如图中a点溶液中各离子浓度的关系是:c(OH-)═c(H+)+c(CH3COO-)+2c(CH3COOH) |
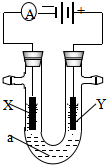 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: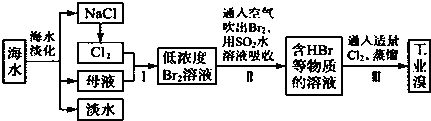
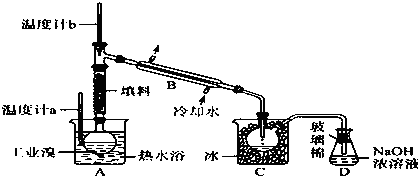
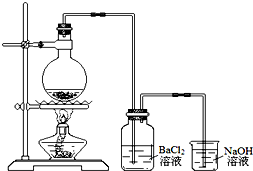 某学习小组探究铜跟浓硫酸反应的情况.取6.4g铜片和10mL 18mol•L-1的浓硫酸放在圆底烧瓶中,按如图所示装置进行实验.
某学习小组探究铜跟浓硫酸反应的情况.取6.4g铜片和10mL 18mol•L-1的浓硫酸放在圆底烧瓶中,按如图所示装置进行实验.