题目内容
13.用NA表示阿伏加德罗常数的数值,下列说法正确的是( )| A. | 标准状况下,22.4L H2O含有NA个分子 | |
| B. | 1L 1mol•L -1的NaClO 溶液中含有ClO-的数目少于NA个 | |
| C. | 0.1molAlCl3完全转化为氢氧化铝胶体,生成0.l NA个胶体粒子 | |
| D. | 0.1molCl2与足量NaOH溶液反应,转移电子数为0.2 NA |
分析 A、标况下水为液态;
B、次氯酸根为弱酸根,在溶液中会水解;
C、一个氢氧化铝胶粒是多个氢氧化铝的聚集体;
D、氯气和碱的反应为歧化反应.
解答 解:A.在标准状况下H2O是液态,不能使用气体摩尔体积来计算其物质的量和分子个数,故A错误;
B.由于NaClO 是强碱弱酸盐,弱酸根离子会发生水解反应而消耗,所以在1L 1mol•L -1的NaClO 溶液中含有ClO-的数目少于NA个,故B正确;
C.胶体粒子是许多氢氧化铁聚集的颗粒,故生成的胶体粒子小于0.l NA,故C错误;
D.氯气和碱的反应为歧化反应,1mol氯气转移1mol电子,故0.1molCl2与足量NaOH溶液反应,转移电子数为0.1 NA,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
3.将常温常压下的a L SO2和b L H2S混合,当完全反应后,气体体积是反应前的$\frac{1}{4}$,则a与b的比值可能是( )
| A. | 1:1 | B. | 1:2 | C. | 3:1 | D. | 1:3 |
4.把0.02 mol/LCH3COOH溶液和0.01 mol/L NaOH溶液以等体积混合,则混合液中粒子浓度关系正确的为( )
| A. | c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-) | B. | c(HAc)>c(CH3COO-) | ||
| C. | 2c(H+)=c(CH3COO-)-c(CH3COOH) | D. | c(CH3COOH)+c(CH3COO-)=0.02mol/L |
18.根据反应式:(1)Br2+2I-=2Br-+I2 (2)Cl2+2Br-=Br2+2Cl-可判断离子的氧化性由强到弱的顺序是( )
| A. | Cl2、Br2、I2 | B. | Br2、Cl2、I2 | C. | I2、Cl2、Br2 | D. | I2、Br2、Cl2 |
5.在一定温度下,可逆反应A(g)+3B(g)?2C(g)达到平衡的标志是( )
| A. | C生成的速率与C分解的速率不相等 | |
| B. | A、B、C的浓度不再变化 | |
| C. | 单位时间生成nmolA,同时生成3nmolB | |
| D. | A、B、C的分子数之比为1:3:2 |
3.柴达木盆地以青藏高原“聚宝盆”之誉蜚声海内外,它有富足得令人惊讶的盐矿资源.液体矿床以钾矿为主,伴生着镁、溴等多种矿产.某研究性学习小组拟取盐湖苦卤的浓缩液(富含K+、Mg2+、Br-、SO42-、Cl-等),来制取较纯净的氯化钾晶体及液溴(Br2),他们设计了如图1流程:
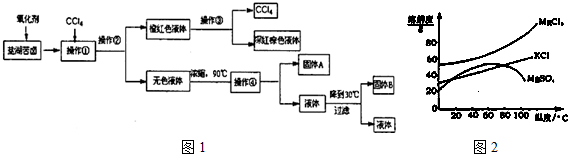
请根据以上流程,回答相关问题:
(1)操作②的所需的主要仪器是分液漏斗.
(2)参照图2溶解度曲线,得到的固体A的主要成分是MgSO4(填化学式).
(3)同学甲提出一些新的方案,对上述操作②后无色溶液进行除杂提纯,其方案如下:
【有关资料】
【设计除杂过程】
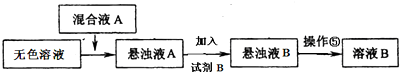
①已知试剂B是K2CO3溶液,则混合液A的主要成分是Ba(OH)2(或BaCl2和KOH)(填化学式).
【获取纯净氯化钾】
②对溶液B加热并不断滴加l mol•L一1的盐酸溶液,同时用pH试纸检测溶液,直至pH=5时停止加盐酸,得到溶液C.该操作的目的是加盐酸调节至pH=5目的是除去未反应的OH-和CO32-.
③将溶液C倒入 蒸发皿中,加热蒸发并用玻璃棒不断搅拌,直到出现较多晶体,剩余较少水时时(填现象),停止加热.
【问题讨论】
④进行操作⑤中控制溶液pH=12可确保Mg2+除尽,根据提供的数据计算,此时溶液B中Mg2+物质的量浓度为1.6×10-7mol/L.

请根据以上流程,回答相关问题:
(1)操作②的所需的主要仪器是分液漏斗.
(2)参照图2溶解度曲线,得到的固体A的主要成分是MgSO4(填化学式).
(3)同学甲提出一些新的方案,对上述操作②后无色溶液进行除杂提纯,其方案如下:
【有关资料】
| 化学式 | BaCO3 | BaSO4 | Ca(OH)2 | MgCO3 | Mg(OH)2 |
| Ksp | 8.1×10一9 | 1.08×10一10 | 1.0×10一4 | 3.5×10一5 | 1.6×10一11 |

①已知试剂B是K2CO3溶液,则混合液A的主要成分是Ba(OH)2(或BaCl2和KOH)(填化学式).
【获取纯净氯化钾】
②对溶液B加热并不断滴加l mol•L一1的盐酸溶液,同时用pH试纸检测溶液,直至pH=5时停止加盐酸,得到溶液C.该操作的目的是加盐酸调节至pH=5目的是除去未反应的OH-和CO32-.
③将溶液C倒入 蒸发皿中,加热蒸发并用玻璃棒不断搅拌,直到出现较多晶体,剩余较少水时时(填现象),停止加热.
【问题讨论】
④进行操作⑤中控制溶液pH=12可确保Mg2+除尽,根据提供的数据计算,此时溶液B中Mg2+物质的量浓度为1.6×10-7mol/L.
 .
.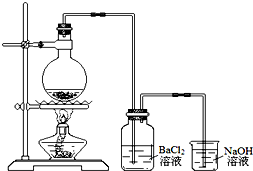 某学习小组探究铜跟浓硫酸反应的情况.取6.4g铜片和10mL 18mol•L-1的浓硫酸放在圆底烧瓶中,按如图所示装置进行实验.
某学习小组探究铜跟浓硫酸反应的情况.取6.4g铜片和10mL 18mol•L-1的浓硫酸放在圆底烧瓶中,按如图所示装置进行实验.