题目内容
5.某化学小组用MnO2和浓盐酸共热制取氯气时,利用刚吸收过SO2的NaOH溶液对尾气进行吸收处理.请按要求回答下列问题:(1)请写出用此法制取Cl2的离子方程式:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)该尾气吸收处理一段时间后,吸收液中(假设不含酸式盐)肯定存在的阴离子有OH-、SO42-、Cl-;对可能大量存在的其他阴离子(不考虑空气中CO2的影响)设计如下实验进行探究.
①提出假设:
假设1:只存在SO32-;假设2.只存在ClO-;假设3:既存在SO32-也存在ClO-.
②质疑讨论:经分析假设3不合理,理由是SO32-具有强还原性,ClO-具有强氧化性,两者发生氧化还原反应而不能大量共存.
③实验方案设计与分析:
限选试剂:3moL•L-1 H2SO4、1moL•L-1 NaOH、0.01mol•L-1 KMnO4紫色石蕊试液.
实验步骤 预期现象和结论
步骤一:取少量吸收液于试管中,滴加3mol•L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中.
步骤二:在A试管中滴加0.01mol•L-1KMnO4溶液,振荡. 若紫红色褪去,则说明假设1成立.
步骤三:在B试管中滴加紫色石蕊溶液,振荡 若先变红后褪色,则说明假设2成立.
(3)假设有224mL(标准状况下)SO2被15mL 1mol•L-1的NaOH溶液完全吸收,得溶液X.忽略盐类的水解,所得X溶液中溶质正盐的物质的量为0.005mol.
若用0.2000mol•L-1 KIO3溶液恰好将上述溶液X中所有的硫元素氧化,还原产物为I2,则消耗KIO3溶液的体积为20L.
分析 (1)MnO2和浓盐酸加热反应生成氯气、氯化锰和水;
(2)利用刚吸收过少量SO2的NaOH溶液吸收含有氯气的尾气,根据溶液中发生的反应分析存在的阴离子;
①可假设1:只存在SO32-;假设2只存在ClO-;假设3:既不存在SO32-,也不存在ClO-;
②SO32-具有还原性,ClO-具有氧化性,二者不能共存;
③根据所限制实验试剂和SO32-、ClO-的性质,先加入硫酸至酸性,若存在SO32-、ClO-,分别生成了H2SO3和HClO;H2SO3具有还原性,选择具有强氧化性的高锰酸钾溶液,证明SO32-的存在;因为HClO具有强氧化性,紫色石蕊溶液,证明有ClO-的存在;
(3)首先计算SO2和NaOH的物质的量,判断反应产物,列方程式计算相关物理量;根据转移电子数相等来计算消耗KIO3溶液的体积.
解答 解:(1)MnO2和浓盐酸加热反应生成氯气、氯化锰和水,其反应的离子方程式为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)利用刚吸收过少量SO2的NaOH溶液吸收含有氯气的尾气,少量的SO2与NaOH溶液反应生成Na2SO3,Na2SO3被氯气氧化生成硫酸钠,其反应方程式为Cl2+Na2SO3+2NaOH=2NaCl+Na2SO4+H2O,故一定存在SO42-、Cl-,
故答案为:SO42-、Cl-;
(3)由已知假设1、只存在SO32-,假设3、既存在SO32-也存在ClO-,可知假设2为为:只存在ClO-,
故答案为:只存在ClO-;
②SO32-具有强还原性,ClO-具有强氧化性,两者发生氧化还原反应而不能大量共存,
故答案为:SO32-具有强还原性,ClO-具有强氧化性,两者发生氧化还原反应而不能大量共存;
③因为吸收液呈碱性,先取少量吸收液于试管中,滴加3moL•L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中先加入硫酸的试管,若存在SO32-、ClO-,分别生成了H2SO3和HClO;
在A试管中滴加0.01mol•L-1KMnO4溶液,若紫红色褪去,证明有SO32-,则说明假设1成立;
在B试管中滴加紫色石蕊溶液,若溶液先变红后褪色,证明有ClO-,则说明假设2成立,
故答案为:0.01mol•L-1KMnO4溶液;紫红色褪去;紫色石蕊溶液;先变红后褪色;
(3)n (SO2)=$\frac{0.224L}{22.4L/mol}$=0.01mol,n(NaOH)=0.015L×1mol/L=0.015mol,
则反应的可能方程式有:SO2+2NaOH=Na2SO3+H2O,SO2+NaOH=NaHSO3,
则有:2>$\frac{n(NaOH)}{n(SO{\;}_{2})}$=$\frac{3}{2}$>1,
所以:所得产物为Na2SO3和NaHSO3,
设所得产物中含Na2SO3为xmol,NaHSO3为ymol则得方程组:$\left\{\begin{array}{l}{x+y=0.01\\;}\\{2x+y=0.015}\end{array}\right.$,解得:x=0.005,y=0.005,即正盐的物质的量为:0.005mol;
设0.2000mol•L-1 KIO3溶液VL恰好将上述溶液X中所有的硫元素氧化,还原产物为I2,则KIO3得电子总数为:0.2000mol/L×VL×(5-0),
X溶液中硫失电子总数为:0.01mol×(6-4),根据得失电子总数相等得:0.2000mol/L×VL×(5-0)=0.01mol×(6-4),解答V=20mL,
故答案为:0.005mol;20.
点评 本题属于实验探究题,要根据实验原理提出假设,再结合物质的性质加以验证,侧重于考查学生的实验探究能力和对知识的应用能力,题目难度中等.计算时注意先判断反应产物,利用氧化还原反应中转移电子数相等来计算可简化计算过程.

 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案| A. | 待检液加入氯化钡溶液有白色沉淀生成,再加入盐酸沉淀消失且产生无色无味的气体,则待检液中一定含有CO32- | |
| B. | 加入氯化钡溶液有白色沉淀生成,再加稀硝酸,沉淀不消失,一定含有SO42- | |
| C. | 将氢气在某气体中点燃,若产生苍白色火焰,则该气体为氯气 | |
| D. | 待检液加入NaOH溶液并加热,有能使湿润的红色石蕊试纸变蓝的气体生成,则原溶液中一定含有NH4+ |
| A. | 2.7 mol/L | B. | 1.35 mol/L | C. | 0.9 mol/L | D. | 0.45 mol/L |
| A. | 电解饱和食盐水可以得到氯气 | |
| B. | 金属钠在高温下能将TiCl4中的钛置换出来 | |
| C. | 金属镁燃烧后会发出耀眼的白光,因此常用来制造信号弹和焰火 | |
| D. | 金属镁着火,可用二氧化碳灭火 |
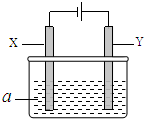 电解原理在化学工业中有广泛应用.如图表示一个电解池,其中a为电解质溶液,X、Y是两块电极板,通过导线与直流电源相连.
电解原理在化学工业中有广泛应用.如图表示一个电解池,其中a为电解质溶液,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
(1)X的电极名称是阴极(填写“阳极”或“阴极”).
(2)若X、Y都是惰性电极,a是硫酸钠溶液,实验开始时,同时在两边各滴入几滴紫色石蕊试液,一段时间后,在X极附近观察到的现象是溶液变为红色,Y极上的电极反应式为4OH--4e-=H2O+O2↑.
(3)若X、Y都是惰性电极,a是AgNO3溶液,电解一段时间后,阳极上产
生气体的体积为0.448L(标准状况下),则阴极上析出金属的质量为8.64g.
(4)若要用该装置电解精炼粗铜,电解液a选用CuSO4溶液,则Y电极的材料是粗铜,X电极的材料是精铜.
(5)若要用电镀方法在铁表面镀一层金属银,应该选择的方案是C.
| 方案 | X | Y | a溶液 |
| A | 银 | 石墨 | AgNO3 |
| B | 银 | 铁 | AgNO3 |
| C | 铁 | 银 | AgNO3 |
| D | 铁 | 银 | Fe(NO3)3 |