题目内容
4.溴化钙用于石油钻井,也用于制造溴化铵及光敏纸、灭火剂、制冷剂等.实验室模拟工业制备CaBr2•2H2O的主要流程如图(a)所示: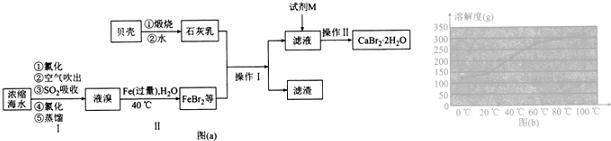
回答下列问题:
(1)已知溴易挥发,Br2的沸点为59℃.
①过程Ⅰ中用SO2吸收溴蒸气,其目的是富集溴元素.
②在过程Ⅰ中蒸馏操作控制的关键条件是控制温度计的温度,并收集59℃的馏分.
(2)过程Ⅱ中控制反应不过于剧烈的操作或措施是分批、缓慢加入液溴或不断搅拌加快热量的散失或将反应置于冷水浴中.
(3)操作I到的玻璃仪器有酒精灯、温度计、蒸馏烧瓶,冷凝管、牛角管、锥形瓶,试剂M为Ca(OH)2(填化学式).
(4)为了获得干燥的CaBr2•2H2O,结合溴化钙的溶解度曲线,操作Ⅱ中包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(5)在50~70℃时,用尿素[CO(NH2)2]、Br2、Ca(OH)2制备溴化钙,此反应中还会生成两种无色无味的气体,写出该反应的化学方程式:CO(NH2)2+3Ca(OH)2 +3Br2$\frac{\underline{\;\;△\;\;}}{\;}$3CaBr2+N2↑+7H2O;.
(6)制得的CaBr2•2H2O可以通过以下方法测定纯度:称取10.00g样品溶于水,滴入足量Na2CO3溶液,充分反应后过滤,将滤渣洗涤、烘干、冷却,称量,得到3.89g固体.则CaBr2•2H2O的质量分数为91.80%.
分析 浓缩海水通过氧化得到溴单质,用热空气吹出再用二氧化硫吸收生成溴化氢,富集溴元素,通入氯气氧化溴化氢为溴单质,蒸馏得到液溴,溶液中加入过量铁粉生成溴化亚铁,贝壳煅烧得到氧化钙,溶于水得到氢氧化钙,氢氧化钙和溴化亚铁反应生成溴化钙和氢氧化亚铁,过滤得到滤液为溴化钙,加入HBr加热蒸发浓缩冷却结晶得到CaBr2•2H2O,
(1)①用热空气吹出再用二氧化硫吸收生成溴化氢,富集溴元素,通入氯气氧化溴化氢为溴单质;
②由于题干中给出信息Br2的沸点是59℃,提纯溴必须收集59℃时的馏分,所以控制温度得到馏分是关键;
(2)根据影响反应速率的影响可知,反应物质加入的快慢、反应温度的高低都对反应速率有影响;
(3)蒸馏操作需要铁架台、酒精灯、石棉网、温度计、冷凝管、牛角管、锥形瓶等仪器;加入的氢氧化钙过量,加溴化氢除去;
(4)溶液中得晶体的操作为蒸发浓缩、冷却结晶、过滤等;
(5)在50~70℃时,用尿素[CO(NH2)2]、Br2、Ca(OH)2反应生成溴化钙、氮气、二氧化碳和水;
(6)根据CaBr2•2H2O~Na2CO3~CaCO3,由碳酸钙的质量求出CaBr2•2H2O,再求出质量分数.
解答 解:(1)①用热空气吹出再用二氧化硫吸收生成溴化氢,富集溴元素,通入氯气氧化溴化氢为溴单质;
故答案为:富集溴元素;
②实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:控制温度计的温度,并收集59℃的馏分,温度过高或过低都不利于溴的收集;
故答案为:控制温度计的温度,并收集59℃的馏分;
(2)由影响反应速率的影响可知,反应物质加入的快慢、反应温度的高低都对反应速率有影响,所以控制反应不过于剧烈的操作或措施是分批、缓慢加入液溴或不断搅拌加快热量的散失或将反应置于冷水浴中,
故答案为:分批、缓慢加入液溴或不断搅拌加快热量的散失或将反应置于冷水浴中;
(3)蒸馏操作需要铁架台、酒精灯、石棉网、温度计、蒸馏烧瓶,冷凝管、牛角管、锥形瓶等仪器,则玻璃仪器有:酒精灯、温度计、蒸馏烧瓶,冷凝管、牛角管、锥形瓶;向滤液中加溴化氢除去多余的氢氧化钙,避免引入杂质离子;
故答案为:酒精灯、温度计、蒸馏烧瓶,冷凝管、牛角管、锥形瓶;Ca(OH)2;
(4)为了获得干燥的CaBr2•2H2O,操作Ⅱ中包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥;
故答案为:洗涤;干燥;
(5)在50~70℃时,用尿素[CO(NH2)2]、Br2、Ca(OH)2反应生成溴化钙、氮气、二氧化碳和水,其反应的化学方程式为:CO(NH2)2+3Ca(OH)2 +3Br2$\frac{\underline{\;\;△\;\;}}{\;}$3CaBr2+N2↑+7H2O;
故答案为:CO(NH2)2+3Ca(OH)2 +3Br2$\frac{\underline{\;\;△\;\;}}{\;}$3CaBr2+N2↑+7H2O;
(6)称取10.00g样品溶于水,滴入足量Na2CO3溶液,充分反应后过滤,将滤渣洗涤、烘干、冷却,称量,得到3.89g固体,则生成的固体为碳酸钙,
设样品中CaBr2•2H2O的质量为xg,
CaBr2•2H2O~Na2CO3~CaCO3,
236 100
xg 3.89g
则x=$\frac{236×3.89g}{100}$=9.18g,
则CaBr2•2H2O的质量分数为$\frac{9.18g}{10.00g}$×100%=91.80%,
故答案为:91.80%.
点评 本题考查了溴化钙晶体的制备实验方案设计,题目涉及化学实验基本操作、除杂质、离子方程式的书写、含量的计算等,题目难度中等,是对学生综合能力的考查,需要学生基本扎实的基础与分析问题、解决问题的能力.

 科学实验活动册系列答案
科学实验活动册系列答案| A. | 其他条件不变,增大该体系的压强,平衡正向移动,则C为气体 | |
| B. | 其他条件不变.若升高温度.B的平衡转化率增大.则该反应是放热反应 | |
| C. | 该反应的化学平衡常数表达式为K=$\frac{{c}^{4}(C)•{c}^{2}(D)}{{c}^{3}(A)•{c}^{2}(B)}$ | |
| D. | 此时.B的平衡转化率是40% |
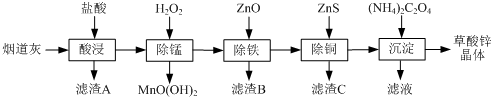
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 4.2 | 5.4 |
| 沉淀完全的pH | 3.3 | 9.7 | 6.7 | 8.2 |
(1)滤渣A的主要成分为SiO2.
(2)除锰过程中产生MnO(OH)2沉淀的离子方程式为Mn2++H2O2+H2O=MnO(OH)2↓+2H+.
(3)①除铁(部分Cu2+可能被除去)时加入ZnO控制反应液pH的范围为3.3~5.4.
②上述流程中除铁与除铜的顺序不能颠倒,否则除铁率会减小,其原因是先加入ZnS会将Fe3+还原为Fe2+,使铁元素难以除去.
(4)若沉淀过程采用Na2C2O4代替(NH4)2C2O4生产草酸锌晶体,合理的加料方式是在搅拌下,将Na2C2O4缓慢加入到ZnCl2溶液中.
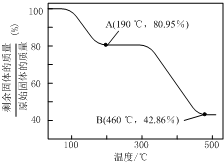
(5)将草酸锌晶体加热分解可得到一种纳米材料.加热过程中固体残留率随温度的变化如右图所示,300℃~460℃范围内,发生反应的化学方程式为ZnC2O4$\frac{\underline{\;\;△\;\;}}{\;}$ZnO+CO↑+CO2↑.
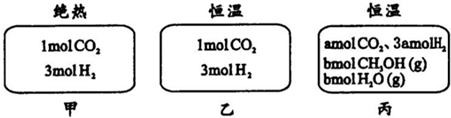
| A. | 刚开始反应时速率:甲<乙 | B. | 平衡后反应放热:甲>乙 | ||
| C. | 500℃下该反应平衡常数:K=3×102 | D. | 若a≠0,则0.9<b<l |
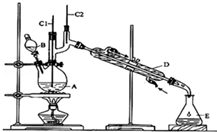 正丁醛是一种化工原料.某实验小组利用如下装置合成正丁醛.
正丁醛是一种化工原料.某实验小组利用如下装置合成正丁醛.发生的反应如下:CH3CH2CH2CH2OH$→_{H_{2}SO_{4}△}^{Na_{2}Cr_{2}O_{2}}$CH3CH2CH2CHO
反应物和产物的相关数据如下:
| 沸点/℃ | 密度(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.5 | 0.8107 | 微溶 |
①将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中.
②在A中加入4.0g正丁醇和几粒沸石,加热.当有蒸汽出现时,开始滴加B中溶液.滴加过程中保持反应温度为90~95℃,在E中收集90℃以下的馏分.
③将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77℃馏分,产量2.0g.
回答下列问题:
(1)B仪器的名称是分液漏斗,D仪器的名称是直形冷凝管.
(2)沸石的作用是防止暴沸.
(3)将正丁醛粗产品置于分液漏斗中分液时,水在下层(填“上”或“下”)
(4)反应温度应保持在90~95℃,其原因是保证正丁醛及时蒸出,又可尽量避免其被进一步氧化.
(5)本实验中,正丁醛的产率为51%.
| A. | 利用溶于水后“过滤”操作能分离NaCl和Ba(OH)2 | |
| B. | 实验结束后,用嘴吹灭酒精灯 | |
| C. | 皮肤上不慎沾上NaOH溶液,立即用盐酸冲洗 | |
| D. | 稀释浓硫酸时,将浓硫酸沿器壁慢慢注入水中,并不断搅拌 |
 以黄铜矿精矿为原料,制取金属铜的工艺如下所示:
以黄铜矿精矿为原料,制取金属铜的工艺如下所示: