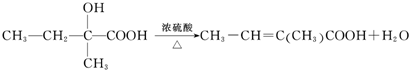
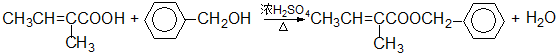题目内容
16.反应4NH3(g)+5O2(g)═4NO(g)+6H2O(g),在2L的密闭容器中进行,1min后,NH3减少了0.12mol,则该反应的化学反应速率表示正确的是( )| A. | NH3:0.002 mol•L-1•s-1 | B. | H2O:0.0015 mol•L-1•s-1 | ||
| C. | NO:0.0015 mol•L-1•s-1 | D. | O2:0.00125 mol•L-1•s-1 |
分析 在2L的密闭容器中进行,1min后,NH3减少了0.12mol,则v(NH3)=$\frac{\frac{0.12mol}{2L}}{60s}$=0.001mol•L-1•s-1,结合速率之比等于化学计量数之比计算.
解答 解:在2L的密闭容器中进行,1min后,NH3减少了0.12mol,则v(NH3)=$\frac{\frac{0.12mol}{2L}}{60s}$=0.001mol•L-1•s-1,
由速率之比等于化学计量数之比可知,
v(NO)=0.001 mol•L-1•s-1,
v(H2O)=0.001 mol•L-1•s-1×$\frac{6}{4}$=0.0015 mol•L-1•s-1,
v(O2)=0.001 mol•L-1•s-1×$\frac{5}{4}$=0.00125 mol•L-1•s-1,
故选BD.
点评 本题考查化学反应速率与化学计量数的关系,为高频考点,把握速率的计算及与化学计量数的关系为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
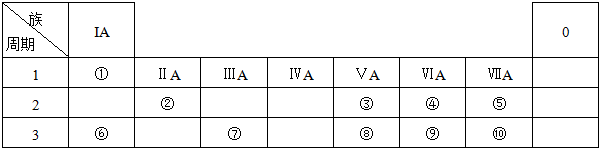
6.图为元素周期表的一部分,请根据元素①-⑧在表中的位置,用化学用语回答下列问题:
(1)在上述元素的最高价氧化物对应的水化物中:属于强酸的是H2SO4、HNO3 (用化学式表示,下同);碱性最强的是NaOH.
(2)④、⑤、⑥的简单离子半径由大到小的顺序是O2->Na+>Al3+ (用离子符号表示).
(3)由①、④、⑤、三种元素组成的化合物中化学键的类型有:离子键、共价键.
(4)请写出涉及上述有关元素的两个置换反应(要求:同一反应中两种单质对应元素既不同周期也不同主族)2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$C+2MgO或Mg+H2SO4=MgSO4+H2↑;
(5)由表中元素形成的常见无机化合物A、B、C、X有以下转化关系:
A$→_{反应①}^{+X一定条件}$B$→_{反应②}^{+X一定条件}$C
若A、B、C含同一金属元素,X为强电解质,且反应都在溶液中进行.B的化学式为Al(OH)3.
对应的反应①的离子方程式为Al3++3OH-=Al(OH)3↓或【Al(OH)4】-+H+=Al(OH)3↓+H2O.
| 族 周期 | IA | 0 | ||||||
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(2)④、⑤、⑥的简单离子半径由大到小的顺序是O2->Na+>Al3+ (用离子符号表示).
(3)由①、④、⑤、三种元素组成的化合物中化学键的类型有:离子键、共价键.
(4)请写出涉及上述有关元素的两个置换反应(要求:同一反应中两种单质对应元素既不同周期也不同主族)2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$C+2MgO或Mg+H2SO4=MgSO4+H2↑;
(5)由表中元素形成的常见无机化合物A、B、C、X有以下转化关系:
A$→_{反应①}^{+X一定条件}$B$→_{反应②}^{+X一定条件}$C
若A、B、C含同一金属元素,X为强电解质,且反应都在溶液中进行.B的化学式为Al(OH)3.
对应的反应①的离子方程式为Al3++3OH-=Al(OH)3↓或【Al(OH)4】-+H+=Al(OH)3↓+H2O.
11.下列反应中属于加成反应的是( )
| A. | 乙烯使溴水褪色 | |
| B. | 将苯滴入溴水中,振荡后水层接近无色 | |
| C. | 乙烯使酸性KMnO4溶液褪色 | |
| D. | 甲烷与氯气混合,黄绿色消失 |
5.面粉厂严禁烟火的主要原因( )
| A. | 防止火灾发生 | B. | 防止污染面粉 | ||
| C. | 吸烟有害健康 | D. | 面粉颗粒极易被引燃而发生爆炸 |
 .
. 由铜片、锌片和200mL稀H2SO4组成的原电池中(如图所示装置),请按要求填空:
由铜片、锌片和200mL稀H2SO4组成的原电池中(如图所示装置),请按要求填空: