题目内容
7.某小组用如图装置进行实验,下列说法不正确的是( )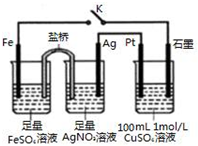
| A. | 盐桥中的电解质不可以用KCl | |
| B. | 导线中通过0.5 mol e-后,向CuSO4溶液中加入12.4g CuCO3,该溶液可恢复原组成 | |
| C. | 闭合K,Pt电极上发生的反应为:4OH--4e-=O2↑+2H2O | |
| D. | 闭合K,整个电路中电流的流向为:Ag电极→Pt电极→石墨电极→Fe电极→Ag电极 |
分析 闭合K时,根据装置可以判断含有盐桥的为原电池装置,其中铁比银活泼为负极,银为正极,盛有硫酸铜溶液的装置为电解装置,与铁相连的石墨为阴极,阴极上铜离子得电子生成Cu,与银相连的Pt为阳极,阳极上氢氧根离子失电子生成氧气,以此解答该题.
解答 解:A.由于KCl能和AgNO3产生沉淀,因此盐桥中的电解质不能用KCl,故A正确;
B.CuSO4溶液中n(Cu2+)=0.1mol,完全消耗时转移电子数为0.2mol,导线中流过0.5mol e-说明水也参与了电解,电解CuSO4的总反应2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+4H+,溶液中减少的是2Cu和O2(相当于2CuO),需要补充0.1molCuO,电解水的总反应2H2O=2H2↑+O2↑,转移电子数为0.3mol,因此消耗0.15mol的H2O,所以只加CuCO3,CuSO4溶液不可恢复原组成,故B错误;
C.与银相连的Pt为阳极,阳极上氢氧根离子失电子生成氧气,其电极方程式为:4OH--4e-═O2↑+2H2O,故C正确;
D.闭合K,电流从正极流向阳极,从阴极流向负极,即电路中电流的流向为:Ag电极→Pt电极→石墨电极→Fe电极→Ag电极,故D正确
故选:B.
点评 本题考查原电池、电解池的工作原理,题目难度中等,注意电极的判断和电极方程式的书写,把握原电池、电解池的工作原理,学习中注意相关知识的把握.

练习册系列答案
相关题目
13.下列反应中符合H++OH-=H2O离子反应的是( )
| A. | 浓硝酸与氢氧化钡溶液 | B. | 稀硫酸与氢氧化钡溶液 | ||
| C. | 稀硫酸与稀氨水 | D. | 盐酸与氢氧化铁胶体反应 |
15.5种固体物质A、B、C、D、E由下表中不同的阴阳离子组成,它们均易溶于水.
分别取它们的水溶液进行实验,结果如下:
①C,E溶液显碱性,A,B,D溶液呈酸性,0.1mol/L的E溶液PH<13;
②B溶液与E溶液混合后产生红褐色沉淀,同时产生大量气体;
③少量C溶液与D溶液混合后产生白色沉淀,过量C溶液与D溶液混合后无现象;
④将38.4g Cu片投入装有足量D溶液的试管中,Cu不溶解,再滴加1.6mol•L-1稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现.
(1)据此推断C、D的化学式为:CBa(OH)2;DAl(NO3)3.
(2)写出步骤②中发生反应的离子反应方程式2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑.
(3)步骤④中若要将Cu片完全溶解,至少加入稀H2SO4的体积是500mL.
(4)不能确定的溶液为B和A(填字母编号).
| 阳离子 | Na+、Al 3+、Fe3+、Cu2+、Ba2+ |
阴离子 | OH-、Cl-、CO32-、NO3-、SO4- |
①C,E溶液显碱性,A,B,D溶液呈酸性,0.1mol/L的E溶液PH<13;
②B溶液与E溶液混合后产生红褐色沉淀,同时产生大量气体;
③少量C溶液与D溶液混合后产生白色沉淀,过量C溶液与D溶液混合后无现象;
④将38.4g Cu片投入装有足量D溶液的试管中,Cu不溶解,再滴加1.6mol•L-1稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现.
(1)据此推断C、D的化学式为:CBa(OH)2;DAl(NO3)3.
(2)写出步骤②中发生反应的离子反应方程式2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑.
(3)步骤④中若要将Cu片完全溶解,至少加入稀H2SO4的体积是500mL.
(4)不能确定的溶液为B和A(填字母编号).
2.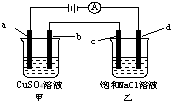 如图所示,a、b、c均为石墨电极,d为碳钢电极,通电电解一段时间.假设在电解过程中产生的气体全部逸出,下列说法正确的是( )
如图所示,a、b、c均为石墨电极,d为碳钢电极,通电电解一段时间.假设在电解过程中产生的气体全部逸出,下列说法正确的是( )
 如图所示,a、b、c均为石墨电极,d为碳钢电极,通电电解一段时间.假设在电解过程中产生的气体全部逸出,下列说法正确的是( )
如图所示,a、b、c均为石墨电极,d为碳钢电极,通电电解一段时间.假设在电解过程中产生的气体全部逸出,下列说法正确的是( )| A. | 甲、乙两烧杯中溶液的pH均保持不变 | |
| B. | 当b极增重3.2 g时,d极产生的气体为0.56 L(标准状况) | |
| C. | 当电解一段时间后,将甲、乙两溶液混合,一定会产生蓝色沉淀 | |
| D. | 甲烧杯中a电极反应式为:4OH--4e-═O2↑+2H2O |
12.检验溶液中的离子或物质,所用方法正确的是( )
| A. | 加入硝酸银溶液,有白色沉淀生成,证明一定有Cl-存在 | |
| B. | 加入BaCl2溶液和稀硝酸,有白色沉淀生成,证明一定有SO42- | |
| C. | 加入碳酸钠溶液产生白色沉淀,再加入盐酸白色沉淀消失,一定有Ba2+ | |
| D. | 加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,一定有NH4+ |
19.在甲、乙、丙三种溶液中各含一种卤素离子,往甲中加淀粉和氯水,则溶液变蓝色,再往丙中加淀粉和氯水,无明显现象.则甲、乙、丙依次含有( )
| A. | Br-、I-、Cl- | B. | I-、Cl-、Br- | C. | I-、Br-、Cl- | D. | Br-、Cl-、I- |