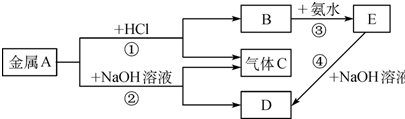
题目内容
12.检验溶液中的离子或物质,所用方法正确的是( )| A. | 加入硝酸银溶液,有白色沉淀生成,证明一定有Cl-存在 | |
| B. | 加入BaCl2溶液和稀硝酸,有白色沉淀生成,证明一定有SO42- | |
| C. | 加入碳酸钠溶液产生白色沉淀,再加入盐酸白色沉淀消失,一定有Ba2+ | |
| D. | 加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,一定有NH4+ |
分析 A.白色沉淀不一定为AgCl;
B.白色沉淀不一定为硫酸钡;
C.可能含有Ca2+等离子;
D.能使湿润的红色石蕊试纸变蓝的气体为氨气.
解答 解:A.可能生成硫酸银、碳酸银等沉淀,白色沉淀不一定为AgCl,不能检验氯离子,应先加硝酸,再加硝酸银检验,故A错误;
B.可能生成氯化银等沉淀,白色沉淀不一定为硫酸钡,不能检验硫酸根离子,应先加盐酸,再加氯化钡检验,故B错误;
C.不一定含有Ba2+,可能含有Ca2+等离子,故C错误;
D.能使湿润的红色石蕊试纸变蓝的气体为氨气,可说明一定有NH4+,故D正确.
故选D.
点评 本题考查混合物的检验和鉴别,为高频考点,侧重于考查学生分析能力、实验能力,注意离子检验的试剂、现象及排除干扰离子,题目难度不大.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
18.将过量铁粉放入100mL3mol/L的HNO3溶液中,假设还原产物只有NO且HNO3完全反应,则参加反应的Fe的质量为( )
| A. | 2.8g | B. | 6.3g | C. | 5.6g | D. | 11.2g |
3.下列关于物质或离子检验的叙述正确的是( )
| A. | 在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+ | |
| B. | 气体通过无水CuSO4,粉末变蓝,证明原气体中含有水蒸气 | |
| C. | 灼烧白色粉末,火焰呈黄色,证明原粉末中有Na+,无K+ | |
| D. | 可以用澄清石灰水,鉴别Na2CO3溶液和NaHCO3溶液 |
20.铅蓄电池是典型的可充电电池,在现代生活中有着广泛的应用,其充电、放电按下式进行:Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O,有关该电池的说法正确的( )
| A. | 放电时,电解质溶液的pH不断降低且正负极均有PbSO4 生成 | |
| B. | 放电时,每通过1mol电子,蓄电池就要消耗2mol H2SO4 | |
| C. | 充电时,阳极反应:PbSO4+2e-=Pb+SO42- | |
| D. | 充电时,铅蓄电池的负极与外接电源的负极相连 |
7.某小组用如图装置进行实验,下列说法不正确的是( )
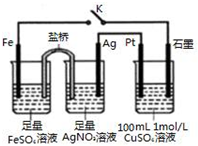

| A. | 盐桥中的电解质不可以用KCl | |
| B. | 导线中通过0.5 mol e-后,向CuSO4溶液中加入12.4g CuCO3,该溶液可恢复原组成 | |
| C. | 闭合K,Pt电极上发生的反应为:4OH--4e-=O2↑+2H2O | |
| D. | 闭合K,整个电路中电流的流向为:Ag电极→Pt电极→石墨电极→Fe电极→Ag电极 |
17.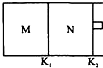 如图所示,隔板K1固定不动,活塞K2可自由移动.T℃时,M、N两个容器中均发生反应N2(g)+3H2(g)?2NH3(g),向容器M、N中各充入l mol N2和3mol H2,初始M、N的容积和温度相同,并保持温度不变.下列说法中不正确的是( )
如图所示,隔板K1固定不动,活塞K2可自由移动.T℃时,M、N两个容器中均发生反应N2(g)+3H2(g)?2NH3(g),向容器M、N中各充入l mol N2和3mol H2,初始M、N的容积和温度相同,并保持温度不变.下列说法中不正确的是( )
 如图所示,隔板K1固定不动,活塞K2可自由移动.T℃时,M、N两个容器中均发生反应N2(g)+3H2(g)?2NH3(g),向容器M、N中各充入l mol N2和3mol H2,初始M、N的容积和温度相同,并保持温度不变.下列说法中不正确的是( )
如图所示,隔板K1固定不动,活塞K2可自由移动.T℃时,M、N两个容器中均发生反应N2(g)+3H2(g)?2NH3(g),向容器M、N中各充入l mol N2和3mol H2,初始M、N的容积和温度相同,并保持温度不变.下列说法中不正确的是( )| A. | 反应达到平衡时N2的转化率:M<N | B. | H2的体积分数:M<N | ||
| C. | NH3的浓度:M<N | D. | 该反应在T℃时的平衡常数K:M=N |
4.下列说法中正确的是( )
| A. | 加入碳酸钠溶液产生白色沉淀,再加盐酸,白色沉淀消失,一定有Ca2+ | |
| B. | 用玻璃棒蘸取新制氯水,点在pH试纸的中央,与标准比色卡比较,测定氯水的pH | |
| C. | 某溶液与NaOH溶液共热,产生使湿润红色石蕊试纸变蓝气体,说明原溶液中存在NH4+ | |
| D. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
1.下列关于影响化学反应速率的因素中,说法错误的是( )
| A. | 升高温度可使吸热反应的反应速率增大,使放热反应的反应速率减小 | |
| B. | 决定化学反应速率的主要因素是参加反应的物质的性质 | |
| C. | 对于有气体参加的反应,增大压强,反应速度加快 | |
| D. | 恒容容器中,在气体反应体系中充入稀有气体,化学反应速率不发生改变 |