题目内容
16.某溶液由Na+、Cu2+、Ba2+、Fe3+、CO32-、SO42-、Cl-中的若干种离子组成.取适量该溶液依次进行如下实验:①向其中加入过量盐酸,有气体生成,并得到无色透明溶液;
②向①所得的滤液中加入过量氢氧化钡溶液,产生白色沉淀,过滤;
③向②所得的滤液中加入过量稀硝酸,再加入硝酸银溶液,产生白色沉淀.
根据上述实验回答下列问题:
(1)原溶液中一定不存在的离子是Cu2+、Ba2+、Fe3+;
(2)写出步骤②中产生白色沉淀的离子反应方程式SO42-+Ba2+=BaSO4↓
(3)原溶液中可能存在的离子是Cl-.为了检验该离子是否存在,应补充的实验为(写出实验过程):取少量原溶液加入过量的Ba(NO3)2待沉淀完全后,向上层清液中滴加HNO3酸化的AgNO3溶液,若产生白色沉淀则含Cl-,否则不含Cl-.
分析 ①向其中加入过量盐酸,有气体生成,并得到无色透明溶液,则溶液中含CO32-,不能含Ba2+、Cu2+、Fe3+,根据溶液要呈电中性,故溶液中一定含Na+;
②向①所得的溶液中加入过量氯化钡溶液,产生白色沉淀,则溶液中含SO42-;
③向②所得的滤液中加入过量稀硝酸,再加入硝酸银溶液,产生白色沉淀,即有AgCl生成,但由于①中加入了HCl,引入了Cl-,故不能确定原溶液中含不含Cl-.以此解答该题.
解答 解:①向其中加入过量盐酸,有气体生成,并得到无色透明溶液,则溶液中含CO32-,不能含Ba2+、Cu2+、Fe3+,根据溶液要呈电中性,故溶液中一定含Na+;
②向①所得的溶液中加入过量氯化钡溶液,产生白色沉淀,则溶液中含SO42-;
③向②所得的滤液中加入过量稀硝酸,再加入硝酸银溶液,产生白色沉淀,即有AgCl生成,但由于①中加入了HCl,引入了Cl-,故不能确定原溶液中含不含Cl-.
(1)由以上分析可知,溶液中一定不存在的离子是:Cu2+、Ba2+、Fe3+,故答案为:Cu2+、Ba2+、Fe3+;
(2)步骤②中产生白色沉淀为硫酸钡,反应的离子方程式为SO42-+Ba2+=BaSO4↓,故答案为:SO42-+Ba2+=BaSO4↓;
(3)但由于①中加入了HCl,引入了Cl-,故不能确定原溶液中含不含Cl-.为了检验该离子是否存在,可取少量原溶液加入过量的Ba(NO3)2待沉淀完全后,向上层清液中滴加HNO3酸化的AgNO3溶液,若产生白色沉淀则含Cl-,否则不含Cl-,
故答案为:Cl-;取少量原溶液加入过量的Ba(NO3)2待沉淀完全后,向上层清液中滴加HNO3酸化的AgNO3溶液,若产生白色沉淀则含Cl-,否则不含Cl-.
点评 本题考查了常见离子的检验方法,为高考常见题型和高频考点,本题充分考查了学生的分析、理解能力,要求熟练掌握常见离子的检验方法,难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | Al与Fe2O3能发生铝热反应,则与MnO2也能发生铝热反应 | |
| B. | AlCl3与过量NaOH溶液反应生成AlO2-,则与过量NH3•H2O反应也生成AlO2- | |
| C. | Fe与Cl2反应生成FeCl3,则与I2反应也生成FeI3 | |
| D. | Na2O2与CO2反应生成Na2CO3和O2,则与SO2反应也生成Na2SO3和O2 |
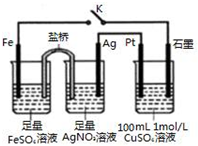
| A. | 盐桥中的电解质不可以用KCl | |
| B. | 导线中通过0.5 mol e-后,向CuSO4溶液中加入12.4g CuCO3,该溶液可恢复原组成 | |
| C. | 闭合K,Pt电极上发生的反应为:4OH--4e-=O2↑+2H2O | |
| D. | 闭合K,整个电路中电流的流向为:Ag电极→Pt电极→石墨电极→Fe电极→Ag电极 |
| A. | 加入碳酸钠溶液产生白色沉淀,再加盐酸,白色沉淀消失,一定有Ca2+ | |
| B. | 用玻璃棒蘸取新制氯水,点在pH试纸的中央,与标准比色卡比较,测定氯水的pH | |
| C. | 某溶液与NaOH溶液共热,产生使湿润红色石蕊试纸变蓝气体,说明原溶液中存在NH4+ | |
| D. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
| A. | 水玻璃做防火材料 | B. | 二氧化硅不和任何酸反应 | ||
| C. | 可用石英坩埚加热氢氧化钠固体 | D. | 光导纤维的主要成分是硅 |
| A. | 升高温度可使吸热反应的反应速率增大,使放热反应的反应速率减小 | |
| B. | 决定化学反应速率的主要因素是参加反应的物质的性质 | |
| C. | 对于有气体参加的反应,增大压强,反应速度加快 | |
| D. | 恒容容器中,在气体反应体系中充入稀有气体,化学反应速率不发生改变 |
(1)合成氨工业中,合成塔中每产生2mol NH3,放出92.2kJ热量.
①工业合成氨的热化学方程式是N2(g)+3H2(g)=2NH3(g)△H=-92.2kJ/mol.
②若起始时向容器内放入1mol N2和3mol H2,达平衡后N2的转化率为20%,则反应放出的热量为Q1kJ,则Q1的数值为18.44;若在同体积的容器中充入2mol N2和6mol H2,达平衡后放出的热量为Q2kJ,则Q2>2Q1(填“>”、“<”或“=”)
③已知:

1mol N-H键断裂吸收的能量约等于391kJ.
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行合成氨反应:N2(g)+3H2(g)?2NH3(g)其化学平衡常数K与温度t的关系如表:请完成下列问题.
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
②下列各项能作为判断该反应达到化学平衡状态的依据是c(填序号字母):
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
③在400℃时,当测得N2、H2和NH3的物质的量分别为2mol、1mol、2mol时,则此时该反应的v(N2)正> v(N2)逆(填写“>”.“=”或“<”)
| A. | 原子半径 P>S>Cl | |
| B. | 最高价氧化物对应水化物的酸性 H3PO4<H2SO4<HClO4 | |
| C. | 氢化物的稳定性 PH3<H2S<HCl | |
| D. | 元素的非金属性 P>S>Cl |