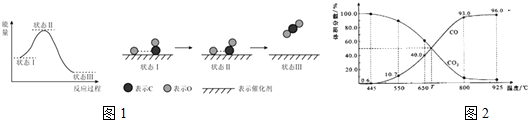
题目内容
5.关于常温下pH=12的NaOH溶液,下列说法正确的是( )| A. | c(OH-)>c(Na+)+c(H+) | |
| B. | 由水电离出的c(OH-)=1.0×10-2mol﹒L-1 | |
| C. | 与等体积pH=2的醋酸混合后所得溶液显碱性 | |
| D. | 与等体积0.01mol﹒L-1氯化铵溶液混合后所得溶液中:c(Na+)=c(Cl-) |
分析 A.依据氢氧化钠溶液中电荷守恒分析判断;
B.依据水溶液中离子积常数计算分析;
C.与等体积pH=2的醋酸混合,醋酸继续电离出氢离子溶液呈酸性;
D.与等体积0.01mol•L-1氯化铵溶液混合,依据溶液中溶质类别分析判断.
解答 解:A.氢氧化钠溶液中存在电荷守恒,c(Na+)+c(H+)=c(OH-),故A错误;
B.常温下pH=12的NaOH溶液,水溶液中离子积常数计算,由水电离出的c(OH-)=1.0×10-12mol•L-1,故B错误;
C.常温下pH=12的NaOH溶液与等体积pH=2的醋酸混合,平衡状态下氢离子和氢氧根离子恰好反应,醋酸继续电离出氢离子溶液呈酸性,故C错误;
D.与等体积0.01mol•L-1氯化铵溶液混合,生成氯化钠和一水合氨,氯化钠为强电解质,完全电离c(Na+)=c(Cl-),故D正确;
故选D.
点评 本题考查了溶液酸碱性的分析判断,弱电解质电离平衡的分析应用,离子积常数的计算,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
15.某烃不与溴水反应,能使酸性高锰酸钾溶液褪色,在Fe存在下与Cl2反应,能生成两种一氯代物,该烃是( )
| A. | CH≡C-CH3 | B. | 对二甲苯 | ||
| C. | 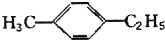 | D. | 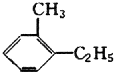 |
13.下列化学式既能表示物质的组成,又能表示物质的一个分子的是( )
| A. | NaOH | B. | SiO2 | C. | Fe | D. | P4 |
20.下列反应属于取代反应的是( )
| A. | CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O | |
| B. | CH2=CH2+Br2→BrCH2CH2Br | |
| C. | CH3CH2CH2Cl+NaOH $→_{△}^{酸}$CH3CH=CH+NaCl+H2O | |
| D. | 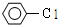 +H2O$→_{△}^{酸}$ +H2O$→_{△}^{酸}$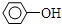 +HCl +HCl |
10.在温度不变的条件下,密闭容器中发生如下反应:2A(g)+3B(g)=2C(g),下列叙述不能够说明反应已经达到平衡状态的是( )
| A. | 2vB正=3vA正 | |
| B. | 3vC正=2vB逆 | |
| C. | 容器中气体的平均相对分子质量不再改变 | |
| D. | 反应容器中压强不随时间变化 |
17.已知Zn(s)+H2SO4(aq)═ZnSO4(aq)+H2(g)△H<0,下列叙述不正确的是( )
| A. | 该反应中旧键断裂吸收的总能量大于新键形成放出的总能量 | |
| B. | 反应物的总能量高于生成物的总能量 | |
| C. | 该反应为放热反应 | |
| D. | 该反应的化学能可以转化为电能 |
14.下列说法正确的是( )
| A. | 元素周期律是按相对原子质量逐渐增大的顺序从左到右排列的 | |
| B. | 最外层电子数相同的元素都是同一族 | |
| C. | 同周期元素原子的电子层数相同数一定相同 | |
| D. | 非金属元素的最外层电子数都大于或等于4 |