题目内容
6.Fe3+和I-在水溶液中反应如下:2I-+2Fe3+?2Fe2++I2(水溶液).(1)当上述反应达到平衡后,加入CCl4萃取I2,且温度不变,化学反应速率减慢(填“增大”“减慢”或“不变”),v(正)>v(逆)填“>”“<”或“=”).
(2)该反应的正反应速率和Fe3+、I-的浓度关系为v=kcm(I-)•cn(Fe3+)(k为常数).
| c(I-)/mol•L-1 | c(Fe3+)/mol•L-1 | v/mol•L-1•s-1 | |
| ① | 0.20 | 0.80 | 0.032k |
| ② | 0.60 | 0.40 | 0.144k |
| ③ | 0.80 | 0.20 | 0.128k |
A.m=1、n=1 B.m=1、n=2 C.m=2、n=1 D.m=2、n=2
I-浓度对反应速率的影响大于(填“>”“<”或“=”)Fe3+浓度对反应速率的影响.
分析 (1)加入CCl4萃取了I2,减小了生成物浓度,反应速率降低,从而使得v(正)>v(逆),导致平衡向右移动;
(2)将表中的三组数据代入公式v=k[c(I-)]m•[c(Fe3+)]n得m和n的值.
解答 解:(1)加入CCl4萃取了I2,减小了生成物浓度,反应速率降低,从而使得v(正)>v(逆),导致平衡向右移动,
故答案为:减慢;>;
(2)将表中的三组数据代入公式v=k[c(I-)]m•[c(Fe3+)]n
得0.20m×0.80n=0.032K,
0.60m×0.40n=0.144K,
0.80m×0.20n=0.128K,
解之得:m=2,n=1,
所以I-浓度对反应速率的影响大,
故答案为:C;大于.
点评 本题考查了了化学平衡常数、反应速率概念的计算,注意对表格中数据的处理,掌握基础是关键,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
17.已知Zn(s)+H2SO4(aq)═ZnSO4(aq)+H2(g)△H<0,下列叙述不正确的是( )
| A. | 该反应中旧键断裂吸收的总能量大于新键形成放出的总能量 | |
| B. | 反应物的总能量高于生成物的总能量 | |
| C. | 该反应为放热反应 | |
| D. | 该反应的化学能可以转化为电能 |
14.下列说法正确的是( )
| A. | 元素周期律是按相对原子质量逐渐增大的顺序从左到右排列的 | |
| B. | 最外层电子数相同的元素都是同一族 | |
| C. | 同周期元素原子的电子层数相同数一定相同 | |
| D. | 非金属元素的最外层电子数都大于或等于4 |
11.下列各组中的四种物质,只用一种试剂即可鉴别的是( )
| A. | 淀粉溶液、乙醇、苯、四氯化碳 | B. | 乙烯、乙烷、乙炔、丙烯 | ||
| C. | 甲酸、乙醛、乙醇、乙酸 | D. | 苯酚、溴苯、苯、甲苯 |
12.常温下,甲、乙、丙三位同学用实验确定某酸HA是弱电解质的方案分别是:
甲:用pH试纸测定0.1moI/L HA溶液的pH,即可证明HA是弱电解质;
乙:①分别取pH=l的HA溶液和稀盐酸各10.00mL,再加水稀释为100mL;
②各取相同体积的两种稀释液(适量),同时分别加入纯度和形状大小均相同的锌粒(足量),观察现象,即可证明HA是弱电解质;
丙:将适量的HA溶液和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如表,分析表中数据可以说明HA是弱电解质;
(1)甲的方案中,说明HA是弱电解质的理由是测得溶液的pH>1(填“>”、“<”或“=”).甲进行实验时的具体操作方法是先把一小块pH试纸放在表面皿或玻璃片上,再用玻璃棒蘸驭溶液点在试纸的中部,待变色后,与标准比色卡对比确定溶液的pH.
(2)在乙的方案的第①步中,需要用到的定量仪器是酸式滴定管.pH均为1的HA溶液和稀盐酸中,水的电离程度的大小关系是c(填字母).
a.HA溶液中水的电离程度大 b.稀盐酸中水的电离程度大 c.两种溶液中水的电离程度相同
(3)乙的方案中,说明HA是弱电解质的主要现象是B(填字母).
A.装稀盐酸的试管中放出H2的速率快
B.装HA溶液的试管中放出H2的速率快
C.两个试管中产生气体的速率一样快
(4)丙的方案中,编号②中的c>(填“>”、“<”或“=”)0.l,该混合液中的离子浓度:c(Na+)=(填“>”、“<”或“=”)c(A-).
(5)丙的方案中,编号③的数据表明,混合溶液中HA的电离程度比NaA的水解程度:强(填“强”、“弱”或“无法确定”).
甲:用pH试纸测定0.1moI/L HA溶液的pH,即可证明HA是弱电解质;
乙:①分别取pH=l的HA溶液和稀盐酸各10.00mL,再加水稀释为100mL;
②各取相同体积的两种稀释液(适量),同时分别加入纯度和形状大小均相同的锌粒(足量),观察现象,即可证明HA是弱电解质;
丙:将适量的HA溶液和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如表,分析表中数据可以说明HA是弱电解质;
| 编号 | NaOH/mol•L-1 | HA/mol•L-1 | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.1 | 0.2 | pH<7 |
(2)在乙的方案的第①步中,需要用到的定量仪器是酸式滴定管.pH均为1的HA溶液和稀盐酸中,水的电离程度的大小关系是c(填字母).
a.HA溶液中水的电离程度大 b.稀盐酸中水的电离程度大 c.两种溶液中水的电离程度相同
(3)乙的方案中,说明HA是弱电解质的主要现象是B(填字母).
A.装稀盐酸的试管中放出H2的速率快
B.装HA溶液的试管中放出H2的速率快
C.两个试管中产生气体的速率一样快
(4)丙的方案中,编号②中的c>(填“>”、“<”或“=”)0.l,该混合液中的离子浓度:c(Na+)=(填“>”、“<”或“=”)c(A-).
(5)丙的方案中,编号③的数据表明,混合溶液中HA的电离程度比NaA的水解程度:强(填“强”、“弱”或“无法确定”).
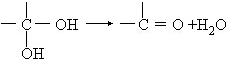
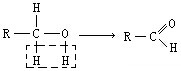
 (在方框中填写有机物的结构简式,说明加氧氧化)
(在方框中填写有机物的结构简式,说明加氧氧化)