题目内容
6.由短周期元素组成的化合物X是某抗酸药的有效成分.甲同学欲探究X的组成.查阅资料:①由短周期元素组成的抗酸药的有效成分有碳酸氢钠、碳酸镁、氢氧化铝、硅酸镁铝、磷酸铝、碱式碳酸镁铝.②Al3+在pH=5.0时沉淀完全;Mg2+在pH=8.8时开始沉淀,在pH=11.4时沉淀完全.
实验过程:
Ⅰ.向化合物X粉末中加入过量盐酸,产生气体A,得到无色溶液.
Ⅱ.用铂丝蘸取少量I中所得的溶液,在火焰上灼烧,无黄色火焰.
Ⅲ.向I中所得的溶液中滴加氨水,调节pH至5~6,产生白色沉淀B,过滤.
Ⅳ.向沉淀B中加过量NaOH溶液,沉淀全部溶解.
Ⅴ.向Ⅲ中得到的滤液中滴加NaOH溶液,调节pH至12,得到白色沉淀C.
(1)Ⅰ中气体A可使澄清石灰水变浑浊,A的化学式是CO2.
(2)由Ⅰ、Ⅱ判断X一定不含有的元素是磷、钠、硅.
(3)Ⅲ中生成B的离子方程式是Al3++3NH3•H20═Al(OH)3↓+3NH4+.
(4)Ⅳ中B溶解的离子方程式是Al(OH)3+OH-═AlO2-+2H2O.
(5)沉淀C的化学式是Mg(OH)2.
(6)若上述n(A):n(B):n(C)=1:1:3,则X的化学式是Mg3Al(OH)7CO3.
分析 Ⅰ、气体A可使澄清石灰水变浑浊,结合抗酸药的有效成分,知该气体为CO2.X中一定不含Si,因为硅酸盐中加入过量盐酸,会产生硅酸沉淀;
Ⅱ、X中一定不含Na,因为Na的焰色为黄色.
Ⅲ、根据题给信息知调节pH至5~6时生成的白色沉淀为Al(OH)3.
Ⅳ、加入过量NaOH溶液,沉淀B完全溶解,离子方程式为:Al(OH)3+OH-═AlO2-+2H2O.
Ⅴ、加入NaOH溶液调节pH至12,有白色沉淀产生,则沉淀C为Mg(OH)2.
综上所述:由于n(CO2):n[Al(OH)3]:n[Mg(OH)2]=1:1:3,则CO32-、Al3+、Mg2+的物质的量之比为1:1:3,结合电荷守恒,则CO32-、Al3+、Mg2+、OH-的物质的量之比为1:1:3:7,故X为Mg3Al(OH)7CO3.
解答 解:(1)气体A可使澄清石灰水变浑浊,结合抗酸药的有效成分,知该气体为CO2,故答案为:CO2;
(2)X中一定不含Si,因为硅酸盐中加入过量盐酸,会产生硅酸沉淀,一定不含Na,因为Na的焰色为黄色,故答案为:钠、硅;
(3)调节pH至5~6时生成的白色沉淀为Al(OH)3,NH3•H20为弱电解质,离子方程式中应写为化学式,故答案为:Al3++3NH3•H20═Al(OH)3↓+3NH4+;
(4)Al(OH)3为两性氢氧化物,能溶于强碱,加入过量NaOH溶液,Al(OH)3沉淀完全溶解,离子方程式为:Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al(OH)3+OH-═AlO2-+2H2O;
(5)加入NaOH溶液调节pH至12,有白色沉淀产生,则沉淀C为Mg(OH)2,故答案为:Mg (OH)2;
(6)由于n(CO2):n[Al(OH)3]:n[Mg(OH)2]=1:1:3,则CO32-、Al3+、Mg2+的物质的量之比为1:1:3,结合电荷守恒,则CO32-、Al3+、Mg2+、OH-的物质的量之比为1:1:3:7,故X为Mg3Al(OH)7CO3.
故答案为:Mg3 Al(OH)7 CO3.
点评 本题考查抗酸药成分的探究实验,为高频考点,侧重于学生的分析、实验和计算能力的考查,题目较为综合,本题易错点为第(6)题,根据质量守恒定律解答.

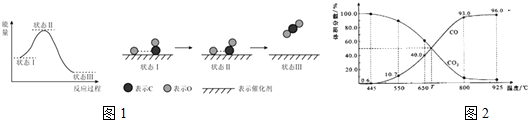
| A. | CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O | |
| B. | CH2=CH2+Br2→BrCH2CH2Br | |
| C. | CH3CH2CH2Cl+NaOH $→_{△}^{酸}$CH3CH=CH+NaCl+H2O | |
| D. |  +H2O$→_{△}^{酸}$ +H2O$→_{△}^{酸}$ +HCl +HCl |
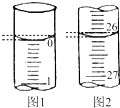 某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液(盛放于锥形瓶中)时,选择酚酞作指示剂,请填写下列空白:
某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液(盛放于锥形瓶中)时,选择酚酞作指示剂,请填写下列空白:(1)滴定时一般左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶,直到加入最后一滴盐酸,溶液溶液颜色由红色变为无色,且半分钟内不变色,即达到滴定终点.若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用盐酸的体积为26.10 mL.
(2)某学生重复三次实验,记录数据如下表所示(待测NaOH溶液的体积均为25.00mL);
| 滴定次数 | 0.1000mol-L-1盐酸的体积/mL | ||
| 滴定前 | 滴定后 | 体积/mL | |
| 1 | 0.10 | 26.21 | 26.11 |
| 2 | 1.56 | 31.30 | 29.74 |
| 3 | 0.22 | 26.31 | 26.09 |
(3)下列操作中可能使所测氢氧化钠溶液的浓度数值偏高的是AC.
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管尖嘴处在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,滴定开始时仰视读数,滴定结束时俯视读数.
| A. | 打开反应釜,将Na 暴露在空气中与氧气反应 | |
| B. | 向反应釜通入Cl2,Na 在Cl2中燃烧生成NaCl | |
| C. | 向反应釜加大量H2O,通过化学反应“除掉”金属钠 | |
| D. | 向反应釜滴加C2H5OH,并设置放气管,排出氢气和热量 |
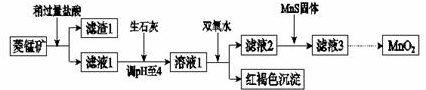
已知:生成氢氧化物沉淀的pH
| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是增大接触面积,提高反应速率.盐酸溶解MnCO3的化学方程式是MnCO3+2HCl=MnCl2+CO2↑+H2O.
(2)向溶液1中加入双氧水时,反应的离子方程式是2Fe2++H2O2+4H2O=2Fe(OH)3↓+4H+.
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,反应的离子方程式是MnS+Cu2+=Mn2++CuS.
(4)将MnCl2转化为MnO2的一种方法是氧化法.其具体做法是用酸化的NaClO3溶液将MnCl2氧化,该反应的离子方程式为:□Mn2++□ClO3-+□4H2O=□Cl2↑+□5MnO2+□8H+.
(5)将MnCl2转化为MnO2的另一种方法是电解法.
①生成MnO2的电极反应式是Mn2+-2e-+2H2O=MnO2+4H+.
②若直接电解MnCl2溶液,生成MnO2的同时会产生少量Cl2.检验Cl2的操作是将润湿的淀粉碘化钾试
 纸置于阳极附近,若试纸变蓝则证明有Cl2生成.
纸置于阳极附近,若试纸变蓝则证明有Cl2生成.③若在上述MnCl2溶液中加入一定量的Mn(NO3)2粉末,则无Cl2产生.其原因是其它条件不变下,增大Mn2+浓度,有利于Mn2+放电(不利于Cl-放电).
| A. | 当a>2b时,发生的离子反应为:2OH-+CO2=CO32-+H2O | |
| B. | 当a<b时,发生的离子反应为:OH-+CO2=HCO3- | |
| C. | 当2a=3b时,发生的离子反应为:3OH-+2CO2=CO32-+HCO3-+H2O | |
| D. | 当0.5a<b<a时,溶液中HCO3-与CO32-的物质的量之比为(a-b):(2b-a) |
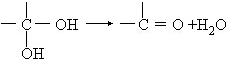
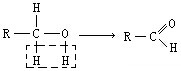
 (在方框中填写有机物的结构简式,说明加氧氧化)
(在方框中填写有机物的结构简式,说明加氧氧化)