题目内容
12.硅是无机非金属材料的主角,工业上可用多种方法制取硅单质.(1)由石英砂可制取粗硅,其相关反应的热化学方程式如下:SiO2(s)+2C(s)═Si(s)+2CO△H=akJ/mol
该反应可分两步进行,其中一步反应为:SiO2(s)+C(s)═SiO(g)+CO(g)△H=bkJ/mol则另一步反应的热化学方程式为C(s)+SiO(s)=Si(s)+CO(g)△H=(a-b)kJ/mol(△H用含a、b的代数式表示)SiO是反应过程中的中间产物.隔绝空气时,SiO与过量KOH溶液反应的(产物之一是硅酸钾,Si+2KOH+H2O═K2SiO3+2H2↑)的化学反应方程式:SiO+2NaOH=Na2SiO3+H2↑.
(2)粗硅提纯常用方法之一是先将粗硅与HCl反应制得SiHCl3,经提纯后再用H2还原:SiHCl3(g)+H2(g)?Si(s)+3HCl(s),不同温度及不同$\frac{n({H}_{2})}{n(SiHC{l}_{3})}$时,反应物X的平衡转化率关系如图所示:

①X是SiHCl3(填“H2”或“SiHCl3”)
②上述反应的平衡常数K (1150℃)>K(950℃)(填“>”、“<”或“=”)
③下列叙述不能证明该反应处于平衡状态的是AE.
A.H2的消耗速率等于HCl生成速率的3倍;
B.恒温恒容条件下体系压强不随时间而变化;
C.绝热恒容条件下体系的温度不随时间而变化;
D.某温度下浓度商Qc不随时间而变化;
E.c(SiHCl3):c(H2):c(HCl)=l:l:3
(3)SiH4(硅烷)法生产高纯多晶硅是非常优异的方法.
①用粗硅做原料,熔融盐电解法制取硅烷原理如图所示,电解时阳极的电极反应式:Si+4H+-4e-=SiH4↑.
②硅基太阳能电池需要N、Si两种元素组成的化合物Y 做钝化材料,它可由SiH4与NH3混合反应得到.已知Y 中Si的质量分数为60%,Y的化学式为:Si3N4.
分析 (1)SiO2(s)+2C(s)═Si(s)+2CO△H=akJ/mol,②、SiO2(s)+C(s)═SiO(g)+CO(g)△H=bkJ/mol
①乘以2加②,即得所求反应;
由元素守恒,可判断出产物除了Na2SiO3外,还有H2;
(2)①两种反应物,增加其中一种,另一种物质的转化率增大,自身的转化率反而减小,横坐标表示氢气的量增多;
②温度越高,SiHCl3的转化率高,即反应进行的程度大;
③SiHCl3(g)+H2(g)?Si(s)+3HCl(s),温度升高转化率增大,平衡常数增大,说明正反应是吸热反应,
(3)①用粗硅作为阳极,H+移向阳极生成SiH4;
②Si的质量分数为60%,氧的质量分数为40%.
解答 解:(1)①、SiO2(s)+2C(s)═Si(s)+2CO△H=akJ/mol,
②、SiO2(s)+C(s)═SiO(g)+CO(g)△H=bkJ/mol
①×2+②,即得所求反应,C(s)+SiO(s)=Si(s)+CO(g)△H=(a-b)kJ/mol,
由元素守恒,可判断出产物除了Na2SiO3外,还有H2,方程式:SiO+2NaOH═Na2SiO3+H2↑,
故答案为:C(s)+SiO(s)=Si(s)+CO(g)△H=(a-b)kJ/mol;SiO+2NaOH═Na2SiO3+H2↑;
(2)①两种反应物,增加其中一种,另一种物质的转化率增大,自身的转化率反而减小,横坐标表示氢气的量增多,所以纵坐标表示的转化率提高应为SiHCl3,
故答案为:SiHCl3;
②当$\frac{n({H}_{2})}{n(N{a}_{2}Si{O}_{3})}$一定时,温度越高,SiHCl3的转化率高,即反应进行的程度大,所以高温时的化学平衡常数大,
故答案为:>;
③SiHCl3(g)+H2(g)?Si(s)+3HCl(s),温度升高转化率增大,平衡常数增大,说明正反应是吸热反应,
A.H2的消耗速率等于HCl生成速率的3倍,只能说明反应正向进行,不能说明反应达到平衡状态,故A错误;
B.反应前后气体体积减小,恒温恒容条件下体系压强不随时间而变化,说明反应达到平衡状态,故B正确;
C.反应是吸热反应绝热恒容条件下体系的温度不随时间而变化,说明反应达到平衡状态,故C正确;
D.某温度下浓度商Qc不随时间而变化说明物质浓度不变是平衡标志,故D正确;
E.c(SiHCl3):c(H2):c(HCl)=l:l:3,和反应比相同,但不能说明正逆反应速率相同,故E错误;
故选AE;
(3)①此题类似于电解精炼铜的原理,用粗铜作为阳极,从图示知,H+移向阳极生成SiH4,电极反应式为Si+4H+-4e-=SiH4↑,故答案为:Si+4H+-4e-=SiH4↑;
②n(Si):n(N)=$\frac{69%}{28}$:$\frac{40%}{14}$=3:4,化学式为Si3N4,故答案为:Si3N4.
点评 本题考查热化学方程式书写,硅及其化合物的性质,化学方程式的书写是解题的关键,平衡标志和平衡影响因素的分析应用,题目难度中等.

 特高级教师点拨系列答案
特高级教师点拨系列答案| A. | 11 22 26 | B. | 13 15 38 | C. | 16 29 31 | D. | 18 21 31 |
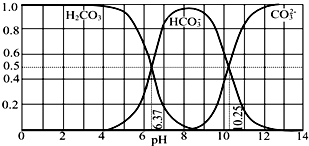
| A. | pH=10.25时,c(Na+)═c(CO32-)+c(HCO3-) | |
| B. | 为获得尽可能纯的NaHCO3,宜控制溶液的pH为7~9之间 | |
| C. | 根据图中数据,可以计算得到H2CO3第一步电离的平衡常数K1(H2CO3)=10-6.37 | |
| D. | 若是0.1mol NaOH 反应后所得的1L溶液,pH=10时,溶液中存在以下关系:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) |
| A. | 实验室用大理石和稀盐酸反应制CO2:CO32-+2H+═CO2↑+H2O | |
| B. | Cl2通入石灰乳中:Cl2+2OH-═Cl-+ClO-+H2O | |
| C. | AlCl3溶液中加入过量稀氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 氢氧化钠溶液腐蚀玻璃:2OH-+SiO2═SiO32-+H2O |
| A. | 根据冷的浓硫酸可以用铝质容器储存的事实,说明常温下铝不与浓硫酸发生反应 | |
| B. | 过氧化钠可作为防毒面具和潜水艇内的供氧剂 | |
| C. | 可用稀硝酸鉴别铜锌合金制成的假金币 | |
| D. | 氢氟酸可用于雕刻玻璃 |

| A. | 白色沉淀A可能能溶解在溶液D | |
| B. | 在甲中滴加丁可能发生反应:HCO3+Ba2++OH-=BaCO3↓+H2O | |
| C. | 溶液丙与I-、N03-、SO42-可以大量共存 | |
| D. | 溶液甲中一定满足:c(H2CO3)+c(H+)═c(OH-)+c(CO32-) |