题目内容
7.“可燃冰”是蕴藏于海底的一种潜在能源.它由盛有“甲烷、氦气、氧气、硫化氢”等分子的“水分子笼”构成.(1)水分子间通过氢键作用相互结合构成水分子笼.N、O、S元素第一电离能由大到小的顺序为N>O>S(填元素符号).
(2)从海底取得的“多金属结核”样本中含“铁、锰、铬”等多种金属.
①基态个原子(Cr)的电子排布式为1s22s22p63s23p63d54s1.
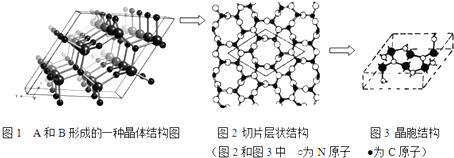
②金属铁的晶体在不同温度下由两种堆积方式,晶胞分别如图1所示.在面心立方晶胞和体心立方晶胞中含有的Fe原子个数之比为2:1;已知,铁原子的半径为12.7×10-9cm,请计算金属铁的面心立方晶胞的晶体密度为8.0g/cm3(结果保留一位小数).
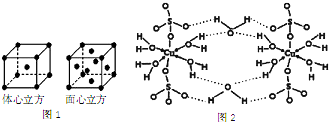
(3)胆矾CuSO4•5H2O可写成[Cu(H2O)4]SO4•H2O,图2是[Cu(H2O)4]SO4•H2O的结构示意图.
①写出基态Cu2+的核外电子排布式1s22s22p63s23p63d9.
②胆矾晶体中不存在的作用力类型有cf(填序号).
a.离子键 b.极性键 c.金属键 d.配位键 e.氢键 f.非极性键.
分析 (1)水分子间通过氢键作用相互结合构成水分子笼;
同主族自上而下第一电离能减小,N元素原子2p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素的;
(2)①Cr原子核外电子数为24,根据能量最低原理与洪特规则特例书写核外电子排布式;
②根据均摊法计算晶胞中Fe原子数目,进而计算面心立方晶胞和体心立方晶胞中含有的Fe原子个数之比;
计算晶胞质量,铁原子的半径为127×10-9cm,则晶胞棱长为127×10-9cm×4×$\frac{\sqrt{2}}{2}$,进而计算晶胞体积,再根据ρ=$\frac{m}{V}$计算晶胞密度;
(3)①Cu原子核外电子排布式为1s22s22p63s23p63d104s1,4s、3d能级各失去1个电子形成Cu2+;
②根据胆矾晶体的结构可知,铜离子与水分子之间形成配位键、水分子与水分子、硫酸根离子之间形成氢键、硫酸根离子与配离子之间形成离子键,硫酸根与水中含有极性键.
解答 解:(1)水分子间通过氢键作用相互结合构成水分子笼;
同主族自上而下第一电离能减小,N元素原子2p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素的,故第一电离能:N>O>S,
故答案为:氢键;N>O>S;
(2)①Cr原子核外电子数为24,根据能量最低原理、洪特规则特例,其核外电子排布式为:1s22s22p63s23p63d54s1,
故答案为:1s22s22p63s23p63d54s1;
②面心立方晶胞中Fe原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,体心立方晶胞中含有的Fe原子数为1+8×$\frac{1}{8}$=2,故面心立方晶胞和体心立方晶胞中含有的Fe原子个数之比为4:2=2:1;
面心立方密晶胞质量为4×$\frac{56}{6.02×1{0}^{23}}$g,铁原子的半径为127×10-9cm,则晶胞棱长为127×10-9cm×4×$\frac{\sqrt{2}}{2}$,则晶胞密度=4×$\frac{56}{6.02×1{0}^{23}}$g÷(12.7×10-9cm×4×$\frac{\sqrt{2}}{2}$)3=8.0g/cm3,
故答案为:2:1;8.0g/cm3;
(3)①Cu原子核外电子排布式为1s22s22p63s23p63d104s1,4s、3d能级各失去1个电子形成Cu2+,基态Cu2+的核外电子排布式为:1s22s22p63s23p63d9,
故答案为:1s22s22p63s23p63d9;
②根据胆矾晶体的结构可知,铜离子与水分子之间形成配位键、水分子与水分子、硫酸根离子之间形成氢键、硫酸根离子与配离子之间形成离子键,硫酸根与水中含有极性键,胆矾晶体中不存在的作用力类型有:金属键、非极性键,
故选:cf.
点评 本题是对物质结构与性质的考查,涉及电离能、核外电子排布、晶胞计算、氢键、配合物等,(2)中晶体密度计算为易错点,关键是计算晶胞体积,难度中等.

| A. | 目前元素周期表有7个周期 | B. | 元素周期表有8个主族 | ||
| C. | ⅢA族元素全部是金属元素 | D. | 非金属元素都在ⅣA~ⅤⅡA和0族 |
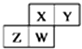 如图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )
如图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )| A. | 原子半径:W>Z>Y>X | |
| B. | 气态氢化物的稳定性:Z>W>X>Y | |
| C. | W的最高正化合价与负化合价的绝对值可能相等 | |
| D. | Z的最高价氧化物的水化物一定为强酸 |
| A. | 25°C时,1L pH=1的硫酸溶液中,含有H+的数目为0.2NA | |
| B. | 2mol SO2与足量氧气在适当的条件下反应生成SO3,转移的电子数为4NA | |
| C. | 含1mol Cl-的NH4Cl溶液中加入适量氨水使溶液呈中性,此时溶液中NH4+数为NA | |
| D. | 2mL 0.5mol/L硅酸钠溶液中滴入过量盐酸制备硅酸胶体,所得胶粒数目为0.001NA |
| A. | F | B. | Cl | C. | Br | D. | I |