题目内容
17.下列离子方程式书写正确的是( )| A. | 实验室用大理石和稀盐酸反应制CO2:CO32-+2H+═CO2↑+H2O | |
| B. | Cl2通入石灰乳中:Cl2+2OH-═Cl-+ClO-+H2O | |
| C. | AlCl3溶液中加入过量稀氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 氢氧化钠溶液腐蚀玻璃:2OH-+SiO2═SiO32-+H2O |
分析 A.碳酸钙为沉淀,应保留化学式;
B.石灰乳中氢氧化钙应保留化学式;
C.不符合反应客观事实;
D.二者反应生成硅酸钠和水.
解答 解:A.实验室用大理石和稀盐酸反应制CO2:CaCO3+2H+═CO2↑+H2O+Ca2+,故A错误;
B.Cl2通入石灰乳中,离子方程式:2Ca(OH)2+2Cl2=2Ca2++2ClO-+2Cl-+2H2O,故B错误;
C.氢氧化铝不溶于氨水,二者反应的离子方程式为:Al3++3NH3•H2O═Al(OH)3↓+3NH4+,故C错误;
D.氢氧化钠溶液腐蚀玻璃,离子方程式:2OH-+SiO2═SiO32-+H2O,故D正确;
故选:D.
点评 本题考查了离子方程式的书写,掌握离子方程式书写原则方法是解题关键,注意化学式的拆分,注意离子反应遵循客观事实,题目难度不大.

练习册系列答案
相关题目
7.如图表示用酸性氢氧燃料电池为电源进行的电解实验.下列说法中正确的是( )
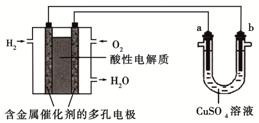

| A. | 燃料电池工作时,正极反应为:O2+2H2O+4e-═4OH- | |
| B. | a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出 | |
| C. | a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出 | |
| D. | a、b两极均是石墨时,a极上产生的O2与电池中消耗的H2的体积比为2:1 |
8.化学与生产、生活、社会密切相关,下列说法中正确的是( )
| A. | 甲烷、乙烯和苯在工业上都可通过石油分馏得到 | |
| B. | 钢铁在潮湿的空气中放置,易发生化学腐蚀而生锈 | |
| C. | 绿色化学的核心是从源头上消除工业生产对环境的污染 | |
| D. | 汽油、柴油和植物油都是碳氢化合物 |
6.用下列实验装置进行相应实验,设计正确且能达到实验目的是( )
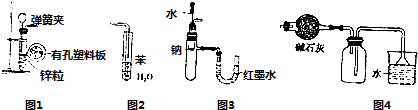

| A. | 用图1所示装置制取少量H2 | |
| B. | 用图2所示装置吸收氨气以防止倒吸 | |
| C. | 用图3所示装置验证Na和水反应的热效应 | |
| D. | 用图4所示装置可用于干燥、收集氯化氢气体 |
1. Bodensteins研究了下列反应:2HI(g)?H2(g)+I2(g)△H═11kJ•mol-1.在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
Bodensteins研究了下列反应:2HI(g)?H2(g)+I2(g)△H═11kJ•mol-1.在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
由实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用如图表示.当改变条件,再次达到平衡时,下列有关叙述不正确的是( )
 Bodensteins研究了下列反应:2HI(g)?H2(g)+I2(g)△H═11kJ•mol-1.在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
Bodensteins研究了下列反应:2HI(g)?H2(g)+I2(g)△H═11kJ•mol-1.在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
| A. | 若升高温度到某一温度,再次达到平衡时,相应点可能分别是A、E | |
| B. | 若再次充入a mol HI,则达到平衡时,相应点的横坐标值不变,纵坐标值增大 | |
| C. | 若改变的条件是增大压强,再次达到平衡时,相应点与改变条件前相同 | |
| D. | 若改变的条件是使用催化剂,再次达到平衡时,相应点与改变条件前不同 |


 (1)已知1molSO2(g)生成1molSO3(g)的能量变化如图所示,回答下列问题:
(1)已知1molSO2(g)生成1molSO3(g)的能量变化如图所示,回答下列问题: