题目内容
3.如图所示,φ(X)为气态反应物在平衡混合物中的体积分数,T为温度.符合该曲线的反应是( )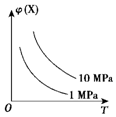
| A. | N2(g)+3H2(g)?2NH3(g)△H<0 | B. | 2HI(g)?H2(g)+I2(g)△H>0 | ||
| C. | 4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0 | D. | C(s)+H2O(g)?H2(g)+CO(g)△H>0 |
分析 根据图示信息知道:当压强不变,升高温度时,气态反应物在平衡混合物中的体积分数减小,即化学平衡正向移动,反应是吸热反应;当温度不变时,增大压强,气态反应物在平衡混合物中的体积分数增大,则化学平衡逆向进行,说明逆向是气体系数和减小的方向,据此回答判断.
解答 解:当压强不变,升高温度时,气态反应物在平衡混合物中的体积分数减小,即化学平衡正向移动,反应是吸热反应;当温度不变时,增大压强,气态反应物在平衡混合物中的体积分数增大,则化学平衡逆向进行,说明逆向是气体系数和减小的方向.
A、N2(g)+3H2(g)?2NH3(g)△H<0该反应是放热反应,且逆向是气体系数和增大的方向,不符合题意,故A错误;
B、2HI(g)?H2(g)+I2(g)△H>0反应前后气体系数和相等的,压强不会引起该平衡的移动,不符合题意,故B错误;
C、4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0该反应是放热反应,不符合题意,故C错误;
D、C(s)+H2O(g)?H2(g)+CO(g)△H>0该反应是吸热反应,且逆向是气体系数和减小的方向,符合题意,故D正确;
故选D.
点评 本题考查学生影响化学平衡移动的因素:温度、压强等,注意图象题的分析方法,固定变量法是常用的处理方式,难度不大.

练习册系列答案
相关题目
15.下列反应的离子方程式正确的是( )
| A. | 稀硝酸和过量铁屑反应:3Fe+8H++2NO3-=3Fe3++2NO↑+4H2O. | |
| B. | 硝酸银溶液和过量的氨水反应:Ag++3NH3•H2O═Ag(NH3)2OH+NH4++2H2O | |
| C. | 向NH4Al(SO4)2溶液中加入过量的Ba(OH)2溶液:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O | |
| D. | 碳酸钠溶液中加入过量苯酚: +CO32-→ +CO32-→ +HCO3- +HCO3- |
11.饮水安全在人们生活中占有极为重要的地位,某研究小组提取三处被污染的水源进行了分析,给出了如下实验信息:其中一处被污染的水源含有A、B两种物质,一处含有C、D两种物质,一处含有E物质.A、B、C、D、E五种常见化合物都是由表中的离子形成:
为了鉴别上述化合物,分别进行以下实验,其结果如下所示:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃片);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)将含1mol A的溶液与含1mol E的溶液反应后蒸干,仅得到一种化合物,该化合物为Na2CO3 .
(2)写出实验②发生反应的离子方程式:Al3++3OH-═Al(OH)3↓,Al(OH)3+OH-═AlO2-+2H2O.
(3)C常用作净水剂,用离子方程式表示其净水原理:Al3++3H2O?Al(OH)3(胶体)+3H+.
| 阳离子 | K+ Na+ Cu2+ Al3+ |
| 阴离子 | SO42- HCO3- NO3- OH- |
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃片);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)将含1mol A的溶液与含1mol E的溶液反应后蒸干,仅得到一种化合物,该化合物为Na2CO3 .
(2)写出实验②发生反应的离子方程式:Al3++3OH-═Al(OH)3↓,Al(OH)3+OH-═AlO2-+2H2O.
(3)C常用作净水剂,用离子方程式表示其净水原理:Al3++3H2O?Al(OH)3(胶体)+3H+.
18.下列叙述错误的是( )
| A. | 10mL质量分数为98%的H2SO4,用10mL水稀释后,H2SO4的质量分数大于49% | |
| B. | 地球上99%的溴蕴藏在大海中,故溴被称为“海洋元素” | |
| C. | 在标况下,将22.4L氨气溶于1L水中,得到1mol/L的氨水 | |
| D. | 向两等份不饱和的烧碱溶液中分别加入一定量的Na2O2和Na2O,使溶液均恰好饱和,则加入的Na2O2与Na2O的物质的量之比等于1:1(保持温度不变) |
8.下列表示的离子方程式正确的是( )
| A. | NH4NO3溶液与氢氧化钠共热:H++OH-═H2O | |
| B. | NH3•H2O滴入AlCl3溶液产生沉淀:3OH-+Al3+═Al(OH)3↓ | |
| C. | NaOH溶液与NaHCO3溶液混合:OH-+H+═H2O | |
| D. | Al(OH)3固体溶于稀硫酸中:Al(OH)3+3H+═Al3++3H2O |
15.下列说法正确的是( )
| A. | 由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定 | |
| B. | 500℃、30M Pa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ/mol | |
| C. | 已知热化学方程式:2SO2(g)+O2?(g) 2SO3(g)△H=-Q kJ/mol,若将一定量的SO2(g)和O2(g)置于密闭容器中充分反应后放出热量Q kJ,则此过程中有2 mol SO2(g)被氧化 | |
| D. | X(g)+Y(g)?Z(g)△H>0,恒温恒容条件下达到平衡后加入X,上述反应△H增大 |
12. 室温下,将0.10mol•L-1的盐酸滴入20mL0.10mol•L-1的氨水中,溶液的pH和pOH随加入盐酸体积变化的曲线如图所示.已知:pOH=-lg c(OH-),下列说法正确的是( )
室温下,将0.10mol•L-1的盐酸滴入20mL0.10mol•L-1的氨水中,溶液的pH和pOH随加入盐酸体积变化的曲线如图所示.已知:pOH=-lg c(OH-),下列说法正确的是( )
 室温下,将0.10mol•L-1的盐酸滴入20mL0.10mol•L-1的氨水中,溶液的pH和pOH随加入盐酸体积变化的曲线如图所示.已知:pOH=-lg c(OH-),下列说法正确的是( )
室温下,将0.10mol•L-1的盐酸滴入20mL0.10mol•L-1的氨水中,溶液的pH和pOH随加入盐酸体积变化的曲线如图所示.已知:pOH=-lg c(OH-),下列说法正确的是( )| A. | M点所示的溶液中c(NH4+)+c(NH3•H2O)=c(Cl-) | |
| B. | Q点所示的溶液中c(NH4+)>c(Cl-)>c(H+)=c(OH-) | |
| C. | N点所示的溶液中c(NH4+)=c(Cl-) | |
| D. | M点和N点所示的溶液中水的电离程度相同 |
13.900℃时,向2.0L恒容密闭容器中充入0.40mol乙苯,发生反应:
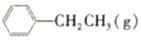 ?
?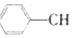 =CH2(g)+H2(g)
=CH2(g)+H2(g)
经一段时间后达到平衡,反应过程中测定的部分数据如表所示:
下列说法正确的是( )
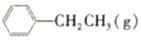 ?
? =CH2(g)+H2(g)
=CH2(g)+H2(g)经一段时间后达到平衡,反应过程中测定的部分数据如表所示:
| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(乙苯)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
| n(苯乙烯)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
| A. | 保持其他条件不变,向容器中充入不参与反应的水蒸气作为稀释剂,则乙苯的转化率大于50.0% | |
| B. | 反应在前20分钟的平均速率为v(H2)=0.008molmol/( L•min) | |
| C. | 若混合气体的平均摩尔质量不再变化,则说明反应已达到平衡状态 | |
| D. | 相同温度下,起始时向容器中充入0.10mol乙苯、0.10mol苯乙烯和0.30molH2,达到平衡前v正>v逆 |