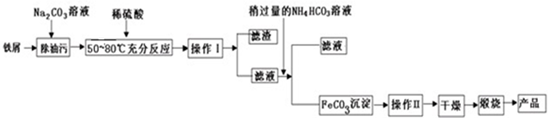
题目内容
16.将绿矾(FeSO4•7H2O)、硫酸铵[(NH4)2SO4]以相等物质的量混合可制得摩尔盐[FeSO4•(NH4)2SO4•6H2O]晶体.
I.根据上图回答:
(1)步骤1中加入Na2CO3溶液的作用洗涤铁屑表面的油污.结合离子方程式简要说明步骤1中加热的原因CO32-+H2O?HCO3-+OH-,加热促进CO32-的水解,增大OH-浓度.
(2)制得的晶体过滤后用无水乙醇洗涤而不用蒸馏水,理由是摩尔盐易溶于水而难溶于乙醇.
Ⅱ.制摩尔盐的原料之一是硫酸铵,评价硫酸铵化肥的主要指标如下:
| 优等品 | 一等品 | 合格品 | |
| 外观 | 白色结晶,无可见机械杂质 | 无可见机械杂质 | |
| 氮(N)含量 | ≥21.0% | ≥21.0% | ≥20.5% |

【观察外观】该硫酸铵化肥无可见机械杂质.
【实验探究】按图示装置进行实验.
【交流讨论】
(1)甲同学:根据此实验测得的数据,计算的硫酸铵化肥的含氮量偏高(填偏高、偏低、或不影响),实验装置中存在一个明显缺陷是缺少干燥装置.
(2)乙同学:实验过程中,往烧瓶中加入的浓氢氧化钠溶液一定要足量并充分加热,原因是NH4++OH-═NH3↑+H2O,使得NH4+全部转化为NH3,最终进入B装置被吸收.
【探究结论】
(3)称取27.0g硫酸铵化肥样品,用改进后的实验装置重新进行实验,测得实验后B装置增重6.8g.则该化肥含氮量为20.7%,由此可判断该化肥的品质.
分析 制取摩尔盐晶体流程为:碳酸钠溶液呈碱性,加热促进碳酸钠水解导致溶液碱性增强,碱促进油脂水解,所以碳酸钠的作用是除去铁表面的油污,然后加稀硫酸溶解,铁和稀硫酸反应生成硫酸亚铁,趁热过滤,然后加入硫酸铵发生(NH4)2 SO4+FeSO4+6H2O=(NH4)2SO4•FeSO4•6H2O↓,结晶过滤,摩尔盐易溶于水,难溶于有机溶剂,用酒精洗涤摩尔盐,得到摩尔盐晶体;
I.(1)碳酸钠溶液为碱性溶液,促进油脂水解;加热促进碳酸钠水解导致碱性增强;
(2)摩尔盐易溶于水而难溶于有机溶剂;
II.(1)水具有挥发性,加热时促进挥发,导致制得的氨气中含有水蒸气;
(2)NH4++OH-═NH3↑+H2O,NaOH足量时使得NH4+全部转化为NH3,加热将气体进入B装置;
(3)根据N原子守恒计算m(N)质量,从而计算其含氮量.
解答 解:制取摩尔盐晶体流程为:碳酸钠溶液呈碱性,加热促进碳酸钠水解导致溶液碱性增强,碱促进油脂水解,所以碳酸钠的作用是除去铁表面的油污,然后加稀硫酸溶解,铁和稀硫酸反应生成硫酸亚铁,趁热过滤,然后加入硫酸铵发生(NH4)2 SO4+FeSO4+6H2O=(NH4)2SO4•FeSO4•6H2O↓,结晶过滤,摩尔盐易溶于水,难溶于有机溶剂,用酒精洗涤摩尔盐,得到摩尔盐晶体;
I.(1)碳酸钠为强碱弱酸盐,碳酸根离子水解导致溶液呈碱性,碱能促进油脂水解且升高温度促进碳酸钠水解,导致溶液碱性增强,所以用碳酸钠洗涤油脂,水解方程式为CO32-+H2O?HCO3-+OH-,
故答案为:洗涤铁屑表面的油污;CO32-+H2O?HCO3-+OH-,加热促进CO32-的水解,增大OH-浓度
;
(2)摩尔盐易溶于水而难溶于有机溶剂乙醇,所以用乙醇洗涤摩尔盐而不是用水洗涤,
故答案为:摩尔盐易溶于水而难溶于乙醇;
II.(1)水具有挥发性,加热时促进挥发,导致制得的氨气中含有水蒸气,导致测定值偏高,为减少误差,应该有干燥氨气装置,
故答案为:偏高;缺少干燥装置;
(2)NH4++OH-═NH3↑+H2O,NaOH足量时使得NH4+全部转化为NH3,加热将气体进入B装置,所以需要NaOH足量且加热,故答案为:NH4++OH-═NH3↑+H2O,NaOH足量时使得NH4+全部转化为NH3,加热将气体进入B装置;
(3)根据N原子守恒得(NH4)2SO4---2NH3,B装置增加的质量为氨气质量,则m(N)=n(N)M(N)=n(NH3)M(N)=$\frac{6.8g}{17g/mol}$×14g/mol=5.6g,则该化肥含氮量=$\frac{5.6g}{27.0g}$×100%=20.7%,所以为合格品,
故答案为:20.7%.
点评 本题考查物质制备,涉及物质制取、盐类水解、实验评价、化学方程式的计算等知识点,侧重考查学生实验操作、实验分析及计算能力,注意原子守恒的灵活运用,题目难度中等.

| A. | 过滤、蒸发、结晶、溶解 | B. | 溶解、蒸发、结晶、过滤 | ||
| C. | 溶解、蒸发、过滤、结晶 | D. | 溶解、过滤、蒸发、结晶 |
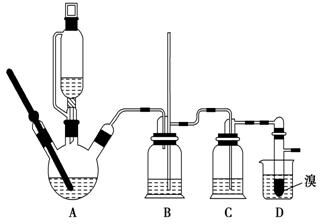 实验室制备1,2二溴乙烷的反应原理如下:CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓)}$CH2═CH2+H2O CH2═CH2+Br2→BrCH2CH2Br
实验室制备1,2二溴乙烷的反应原理如下:CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓)}$CH2═CH2+H2O CH2═CH2+Br2→BrCH2CH2Br可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.用少量溴和足量的乙醇制备1,2二溴乙烷的装置如图所示.
有关数据列表如下:
| 乙醇 | 1,2二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d(填正确选项前的字母).
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入c,其目的是吸收反应中可能生成的酸性气体(填正确选项前的字母).
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是溴的颜色完全褪去.
(4)将1,2二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”).
(5)若产物中有少量未反应的Br2,最好用b洗涤除去(填正确选项前的字母).
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚,可用蒸馏的方法除去.
(7)反应过程中应用冷水冷却装置D,其主要目的是冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
| 物质 | 熔点 | 沸点 | 水溶性 | 相对分子质量 |
| 乙二醇 | -12.9℃ | 197.3℃ | 溶于水、醇 | 62 |
| 甲醇 | -97℃ | 64.7℃ | 与水互溶 | 32 |
| 草酸二甲酯 | 54℃ | 163.5℃ | 微熔于冷水,溶于醇和醚 | 118 |
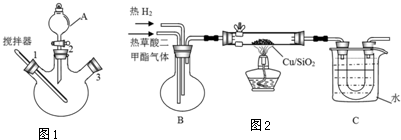
实验室用图1所示装置模拟草酸二甲酯的制备:
步骤1:先往三颈烧瓶中加入甲醇,然后通过A在搅拌器工作时缓慢加入浓硫酸,混合液冷却后,再加入草酸;
步骤2:将A换为球形冷凝管,在3处塞上温度计,在一定的温度下回流2-3小时;
步骤3:将混合液冷凝分离得到草酸二甲酯.
(二)乙二醇的制取
实验室用图2所示的装置模拟工业乙二醇的制取(夹持设备和部分加热装置省略)
反应方程式为:
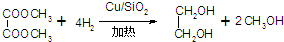
回答下列问题:
(1)仪器A的名称为分液漏斗,步骤3中首个操作是将混合物与冷水混合,则“混合”的正确操作是将混合物沿杯壁慢慢注入装有冷水的烧杯(或容器)中,并不断搅拌.
(2)装置B的作用是使草酸二甲酯和氢气混合均匀.烧杯C中水的温度不能低于55℃,原因是温度低于55℃,未反应的草酸二甲酯会凝结堵塞导管.
(3)对粗产品(主要含乙二醇、草酸二甲酯和甲醇)进行精制,蒸馏收集197.3℃(197℃左右即可)℃的馏分.
(4)实验过程中,使用了16g H2和59g草酸二甲酯,最后得到乙二醇为12.4g,乙二醇的产率为40%.
(5)设计实验证明乙二醇为二元醇:取62g乙二醇,加入足量金属钠充分反应,收集并测量生成的氢气的质量是2g(或其他合理答案,乙二醇与氢气的量符合正确比例即可).
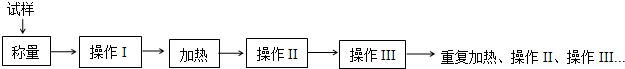
回答下列问题:
(1)实验已有仪器:电子天平、酒精灯、铁三脚架,从下列仪器中选出实验还需要的仪器A、B、E、F、G(用标号字母填写)
A.干燥器 B.研钵 C.试管夹 D.蒸发皿 E.坩埚 F.玻璃棒 G.药匙
除上述列出的仪器外,还需要的仪器是泥三角、坩埚钳.
(2)某学生在实验中得到数据如表.据此计算 x=5.9(精确到0.1)
| 加热前质量 | 加热后质量 | ||
| m1 | m2 | m3 | m4 |
| 5.400g | 7.900g | 6.900g | 6.901g |
a.加热前称量时容器未完全干燥
b.最后两次加热后的质量相差较大
c.加热后容器未放入干燥器中冷却
d.加热过程中有少量溅失.

| A. | 氮气和氢气 | B. | 催化剂 | C. | NH3 | D. | H2 |
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| C(NH3)/mol•L-1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |