题目内容
1.填空:(1)
 的名称是3,3,5,5-四甲基庚烷;
的名称是3,3,5,5-四甲基庚烷;(2)
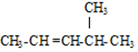 的名称是4-甲基-2-戊烯;
的名称是4-甲基-2-戊烯;(3)已知丙酮(CH3COCH3)键线式可表示为
 ,则键线式为
,则键线式为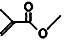 的物质的分子式为C5H8O2;
的物质的分子式为C5H8O2;(4)四联苯
 的一氯代物有5种;
的一氯代物有5种;(5)某烃分子的结构简式为(CH3)2C=CH-
 -CH2-C≡CCH2-CH3,其中共平面的碳原子最多可能有15个.
-CH2-C≡CCH2-CH3,其中共平面的碳原子最多可能有15个.
分析 (1)烷烃命名时,选最长的碳链为主链,从离主链近的一端给主链上的碳原子进行编号,据此分析;
(2)烯烃命名时,应选择含官能团的最长的碳链为主链,从离官能团近的一端给主链上的碳原子进行编号,并标出官能团的位置;
(3)根据该有机物的键线式判断含有的元素名称及数目,然后写出其分子式;
(4)根据“等效氢”的数目分析四联苯的一氯代物,有几种等效氢原子,就有几种一氯代物;
(5)在常见的有机化合物中甲烷是正四面体结构,乙烯和苯是平面型结构,乙炔是直线型结构,其它有机物可在此基础上进行共线、共面分析判断.注意单键可以旋转.
解答 解:(1)烷烃命名时,选最长的碳链为主链,故主链上有7个碳原子,则为庚烷,从离主链近的一端给主链上的碳原子进行编号,则在3号和5号碳原子上各有2个甲基,故名称为:3,3,5,5-四甲基庚烷,故答案为:3,3,5,5-四甲基庚烷;
(2)烯烃命名时,应选择含官能团的最长的碳链为主链,故主链上有5个碳原子,故为戊烯,从离官能团近的一端给主链上的碳原子进行编号,并标出官能团的位置,则双键在2号和3号碳原子间,在4号碳原子上有一个甲基,故名称为:4-甲基-2-戊烯,故答案为:4-甲基-2-戊烯;
(3)键线式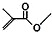 中含有5个C、8个H和2个氧原子,该有机物分子式为:C5H8O2;
中含有5个C、8个H和2个氧原子,该有机物分子式为:C5H8O2;
故答案为:C5H8O2.
(4) 共有18个位置的氢原子可以被取代,根据轴对称可知,1、9、10、18等效,2,8,11,17等效,3,7,12,16等效,4,6,13,15等效,5、14等效,因此四联苯的等效氢原子有5种,因此四联苯的一氯代物的种类为5种,故答案为:5;
共有18个位置的氢原子可以被取代,根据轴对称可知,1、9、10、18等效,2,8,11,17等效,3,7,12,16等效,4,6,13,15等效,5、14等效,因此四联苯的等效氢原子有5种,因此四联苯的一氯代物的种类为5种,故答案为:5;
(5)苯环上的6个碳原子共平面,而C=C为平面结构,故苯环左侧的4个碳原子可以和苯环共平面;而因C≡C为直线型,直接相连的C在同一直线上,则苯环右侧最多5个C共直线,即此有机物中最多15个C原子共面.故答案为:15.
点评 本题考查有机物的命名和结构中共面、共线问题,难度中等,关键是空间想象,做题时注意从甲烷、乙烯、苯和乙炔的结构特点判断有机分子的空间结构,单键可以旋转.

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案| A. | 晶体部分溶解了 | |
| B. | 晶体形状和质量不变 | |
| C. | 晶体的质量增加了,形状也发生了改变 | |
| D. | 晶体的质量不变,形状改变了 |
| A. | 0.1mol/L的Na2CO3溶液加适量水稀释后,溶液中$\frac{c(O{H}^{-})}{c(C{O}_{3}^{2-})}$变大 | |
| B. | 若使Na2S溶液中$\frac{c(N{a}^{+})}{c({S}^{2-})}$接近于2:1,可加入适量的KOH固体 | |
| C. | 0.1mol/LNaOH溶液和0.2mol/LCH3COOH溶液等体积混合后溶液中各离子浓度由大到小的顺序是c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| D. | 已知0.1mol/L NaH2PO4水溶液显酸性,则溶液里各种离子浓度由大到小的顺序是c(Na+)>c(H2PO4-)>c(HPO42-)>c(H+)>c(PO43-)>c(OH-) |