题目内容
6.我国有较长的海岸线,浩渺的海洋是一个巨大的物质资源和能量的宝库.目前,世界各国都在研究如何充分利用海洋资源.Ⅰ.从海水中提取食盐,采用的方法是海水晒盐.粗盐中除含有泥沙等不溶性杂质外,还含有MgCl2、Na2CO3和Na2SO4等可溶性杂质.现欲得到纯净的食盐晶体,需经过多步操作.
(1)将粗盐溶于水,得到悬浊液.为除去不溶性杂质,需要选用的玻璃仪器有漏斗、烧杯和玻璃棒.
(2)检验滤液中含有SO42-的方法是取适量溶液于试管中,滴加足量盐酸,再滴加几滴BaCl2溶液,有白色沉淀生成,说明溶液中含有SO42-.
Ⅱ.世界上60%的镁是从海水中提取的,已知MgO、MgCl2的熔点分别为2800℃、604℃,将MgO、MgCl2加热熔融后通电电解,都可得到金属镁.
(3)海水中含有MgCl2,工业上从海水中提取镁,最合理的方法是D(填字母)
A.海水$\stackrel{NaOH}{→}$Mg(OH)2$\stackrel{电解}{→}$Mg
B.海水$\stackrel{HCl}{→}$ MgCl2溶液→MgCl2熔融$\stackrel{电解}{→}$Mg
C.海水$\stackrel{石灰乳}{→}$Mg(OH)2$\stackrel{灼热}{→}$MgO$\stackrel{电解}{→}$ Mg
D.海水$\stackrel{石灰乳}{→}$Mg(OH)2$\stackrel{HCl}{→}$MgCl2溶液→MgCl2熔融$\stackrel{电解}{→}$Mg
Ⅲ.海水中溴的储藏量十分丰富,约占地球溴总藏量的99%,故溴有“海洋元素”之称,海水中溴含量为65mg•L-1.其工业提取方法有空气吹出纯碱吸收法、溶剂萃取法和空气吹出SO2吸收法:
(4)空气吹出纯碱吸收法是将氯气通入到富含溴离子的海水中,使溴置换出来,再用空气将溴吹出,用纯碱溶液吸收,最后用硫酸酸化,即可得到溴单质.该方法涉及的反应有:
①Cl2+2Br-=Br2+2Cl-(写出离子方程式);
②3Br2+3CO32-═BrO3-+5Br-+3CO2↑;
③BrO3-+5Br-+6H+═3Br2+3H2O.
其中反应②中的氧化剂是Br2.
(5)溶剂萃取法是利用单质溴在不同溶剂中溶解度不同的原理来进行的.下列可以用于萃取溴水中溴的试剂是②④.
①乙醇 ②四氯化碳 ③硝酸 ④苯.
(6)空气吹出SO2吸收法与纯碱吸收法基本相同,不同之处在于将溴吹出后是用SO2来吸收的,使溴转化为氢溴酸,然后再用氯气氧化氢溴酸既得单质溴.写出溴单质与二氧化硫反应的化学方程式:Br2+SO2+2H2O=2HBr+H2SO4.
分析 (1)除去不溶性杂质需要用过滤装置,依据过滤装置选择玻璃仪器;
(2)选盐酸、氯化钡检验硫酸根离子,先加盐酸排除其它离子的干扰;
(3)海水中含有MgCl2,工业上从海水中提取镁,在海水苦卤中加石灰乳过滤得沉淀氢氧化镁,然后加盐酸得到氯化镁,经浓缩、结晶、脱水、电解可以得到金属镁,据此即可解答;
(4)氯气有强氧化性,能氧化溴离子生成溴单质,还原剂失电子化合价升高而发生氧化反应;
(5)用于萃取实验的仪器是分液漏斗,萃取剂的选取标准是:溶质在萃取剂中的溶解度大于在水中的溶解度,萃取剂和原溶剂不互溶,萃取剂和溶质不反应;
(6)溴有氧化性,二氧化硫有还原性,在水溶液里,二氧化硫和溴发生氧化还原反应;
解答 解:(1)除去不溶性杂质可以利用过滤装置分离,用到的玻璃仪器是烧杯、玻璃棒、漏斗,故答案为:玻璃棒;
(2)检验溶液中含有SO42-的方法是取适量溶液于试管中,滴加足量盐酸,再滴加几滴BaCl2溶液,有白色沉淀生成,说明溶液中含有SO42-,
故答案为:取适量溶液于试管中,滴加足量盐酸,再滴加几滴BaCl2溶液,有白色沉淀生成,说明溶液中含有SO42-;
(3)A.在海水苦卤中加氢氧化钠过滤得沉淀氢氧化镁,Mg(OH)2热稳定性差,受热分解,工业上,电解熔融MgCl2冶炼金属镁,故A错误;
B.海水中含有可溶性的Mg2+、Ca2+、Fe3+、SO42-、Na+、Cl-、加盐酸得不到纯净的氯化镁溶液,所以无法得到纯净的氯化镁固体,故B错误;
C.在海水苦卤中加氢氧化钠过滤得沉淀氢氧化镁,灼烧得到氧化镁,但MgO的熔点为2800℃、熔点高,电解时耗能高,所以,工业上,电解熔融MgCl2冶炼金属镁,故C错误;
D.在海水苦卤中加氢氧化钠过滤得沉淀氢氧化镁,再将沉淀分离后加入盐酸变成MgCl2,之后经过滤、干燥、电解,即可得到金属镁,故D正确;
故答案为:D;
(4)氯气有强氧化性,能氧化溴离子生成溴单质,自身被还原生成氯离子,离子反应方程式为:Cl2+2Br-=Br2+2Cl-;Br2+3CO32-=BrO3-+5Br-+3CO2↑中Br2的化合价由0价变为+5价和-1价,所以Br2是氧化剂发生还原反应,也是还原剂发生氧化反应,还原剂、氧化剂都为Br2,③BrO3-+5Br-+6H+═3Br2+3H2O.中的还原剂是Br-,
故答案为:Cl2+2Br-=Br2+2Cl-;Br2;
(5)用于萃取实验的仪器是分液漏斗,萃取剂的选取标准是:溶质在萃取剂中的溶解度大于在水中的溶解度,萃取剂和原溶剂不互溶,萃取剂和溶质不反应,根据萃取剂的选取标准知,乙醇、硝酸都和水互溶,所以不能作萃取剂,能作萃取剂的是四氯化碳、苯,
故答案为:②④;
(6)溴有氧化性,二氧化硫有还原性,在水溶液里,二氧化硫和溴发生氧化还原反应生成硫酸和氢溴酸,反应方程式为:Br2+SO2+2H2O=2HBr+H2SO4;
故答案为:Br2+SO2+2H2O=2HBr+H2SO4.
点评 本题以海水资源的综合利用为载体综合考查物质的分离、提纯,侧重于学生的分析、实验能力的考查,题目难度中等,涉及萃取剂的选取、氧化还原反应、等知识点,基本概念、基本理论是解答关键.

 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案| A. | 硅在自然界中既有游离态又有化合态 | |
| B. | 高温下SiO2能与Na2CO3固体反应生成Na2SiO3和CO2,说明硅酸酸性强于碳酸 | |
| C. | 因为玻璃中含有SiO2,所以不能用磨口玻璃塞的试剂瓶盛装碱性溶液 | |
| D. | SiO2能与氢氧化钠溶液和氢氟酸反应,所以SiO2是两性氧化物 |
| A. | Na+、Al3+、SO42-、Cl- | B. | Na+、Fe2+、SO42-、NO3- | ||
| C. | Al3+、Na+、Cl-、AlO2- | D. | K+、Cu2+、OH-、SO42- |
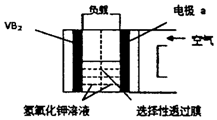 硼化钒(VB2)-空气电池是目前储电能力最高的电池(如图所示),电池总反应为:4VB2+11O2═4B2O3+2V2O5,下列叙述错误的是( )
硼化钒(VB2)-空气电池是目前储电能力最高的电池(如图所示),电池总反应为:4VB2+11O2═4B2O3+2V2O5,下列叙述错误的是( )| A. | 负极反应式为4VB2+44OH-═2V2O5+4B2O3+22H2O | |
| B. | 正极反应式为11O2+44e-+22H2O=44OH- | |
| C. | OH-由负极透过性选择性透过膜向正极迁移 | |
| D. | 电子由硼化钒电极负载流向电极a |
| A. | 葡萄酒中添加SO2,可起到抗氧化和抗菌的作用 | |
| B. | PM2.5颗粒分散到空气中可产生丁达尔效应 | |
| C. | 苯、四氯化碳、乙醇都可作萃取剂,也都能燃烧 | |
| D. | 淀粉、油脂、纤维素和蛋白质都是高分子化合物 |
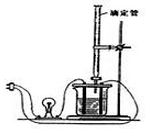 利用如图装置做下面的实验:在烧杯里盛半杯0.1mol/L乙溶液,然后用滴定管向容器里滴入0.1mol/L甲溶液.随着甲的滴入,电灯渐渐变暗亮,滴到一定量后,继续滴入甲溶液,电灯又会逐渐变暗.下列各组溶液中(甲在前,乙在后),能够产生上述现象的是( )
利用如图装置做下面的实验:在烧杯里盛半杯0.1mol/L乙溶液,然后用滴定管向容器里滴入0.1mol/L甲溶液.随着甲的滴入,电灯渐渐变暗亮,滴到一定量后,继续滴入甲溶液,电灯又会逐渐变暗.下列各组溶液中(甲在前,乙在后),能够产生上述现象的是( )| A. | NH3•H2O、AgNO3 | B. | CH3COOH、NH3•H2O | C. | NaOH、AlCl3 | D. | H2SO4、Ba(OH)2 |
 的名称是3,3,5,5-四甲基庚烷;
的名称是3,3,5,5-四甲基庚烷;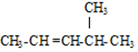 的名称是4-甲基-2-戊烯;
的名称是4-甲基-2-戊烯; ,则键线式为
,则键线式为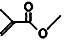 的物质的分子式为C5H8O2;
的物质的分子式为C5H8O2; 的一氯代物有5种;
的一氯代物有5种; -CH2-C≡CCH2-CH3,其中共平面的碳原子最多可能有15个.
-CH2-C≡CCH2-CH3,其中共平面的碳原子最多可能有15个.