题目内容
5.已知3.25g某金属X与过量稀硝酸反应,在反应过程中未见有气体生成,反应后在所得溶液中加入热碱溶液可放出一种气体,其体积为280mL(标准状况),则X为( )| A. | Zn | B. | Fe | C. | Cu | D. | Ag |
分析 硝酸越稀,还原产物中氮元素的价态越低.金属X跟过量稀硝酸反应,在反应过程中未见有气体生成,则说明硝酸被还原为NH3,又接着被HNO3吸收生成了NH4NO3,在所得溶液中加入热碱溶液可放出一种气体即为NH3,根据氨气的体积求出其物质的量,结合电子守恒计算.
解答 解:硝酸越稀,还原产物中氮元素的价态越低.金属X跟过量稀硝酸反应,在反应过程中未见有气体生成,则说明硝酸被还原为NH3,又接着NH3被HNO3吸收生成了NH4NO3,故表现为无气体生成.在所得溶液中加入热碱溶液可放出一种气体即为NH3,体积为280mL,则生成的氨气的物质的量n=$\frac{0.28L}{22.4L/mol}$=0.0125mol.
设每失去1mol电子所需要的X的质量为x,即金属X的平均摩尔电子质量为x g/mol,
故3.25g金属X失去的电子的物质的量n=$\frac{3.25g}{xg/mol}$=$\frac{3.25}{x}$mol ①
而由硝酸生成0.0125mol氨气时得到电子的物质的量n=0.0125mol×8=0.1mol ②
由氧化还原反应中得失电子数守恒可知:$\frac{3.25}{x}$=0.1
解得x=32.5g/mol.
即此金属X每失去1mol电子所需的质量为32.5g,只有金属为锌符合,
故选A.
点评 本题考查氧化还原反应的计算,为高频考点,把握元素的化合价变化、电子守恒为解答的关键,侧重分析与计算能力的考查,注意守恒法的应用,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案
相关题目
13.下列A-D四组,每组有两个反应,其中两个反应能用同一离子方程式表示的是:( )
| (Ⅰ) | (Ⅱ) | |
| A | 少量H2SO4滴入Ba(OH)2溶液中 | 少量NaHSO4滴入Ba(OH)2溶液中 |
| B | 少量NaOH滴入Al2(SO4)3溶液中 | 少量Al2(SO4)3溶液滴入氨水中 |
| C | FeO与足量的盐酸 | FeO与足量的稀硝酸 |
| D | 0.1mol Cl2通入含0.2mol FeBr2的溶液中 | 0.1mol Cl2通入含0.2mol FeCl2的溶液中 |
| A. | A | B. | B | C. | C | D. | D |
20.下列说法错误的是( )
| A. | 利用丁达尔效应可区分蛋白质溶液与葡萄糖溶液 | |
| B. | 某物质经科学测定只含有一种元素,则可以断定该物质是一种纯净物 | |
| C. | 用过滤法无法除去Fe(OH)3胶体中的FeCl3 | |
| D. | 升高温度纯水的离子积增大,但pH减小 |
10.我国第五套人民币中的一元硬币材料为钢芯镀镍,依据你所掌握的电镀原理,你认为在硬币制作时,下列操作正确的是( )
①将钢芯接在电池的正极上,②将镍接在电源的正极上,③在钢芯上发生的反应是:Ni2++2e-=Ni,④在镍上发生的反应是:4OH--4e-=O2+2H2O,⑤需用FeSO4溶液,⑥用NiSO4溶液作电解液.
①将钢芯接在电池的正极上,②将镍接在电源的正极上,③在钢芯上发生的反应是:Ni2++2e-=Ni,④在镍上发生的反应是:4OH--4e-=O2+2H2O,⑤需用FeSO4溶液,⑥用NiSO4溶液作电解液.
| A. | ①③⑥ | B. | ②③⑥ | C. | ①④⑤ | D. | ②③④⑥ |
14.下列有关说法正确的是( )
| A. | CaCO3(s)═CaO(s)+CO2(g)在室温下不能自发进行,说明该反应的△H<0 | |
| B. | 焓变和熵变是判断反应方向的两个主要因素 | |
| C. | N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,反应速率v(H2)和H2的平衡转化率均增大 | |
| D. | 任何情况下,温度都不可能对反应的方向起决定性作用 |
 的名称是3,3,5,5-四甲基庚烷;
的名称是3,3,5,5-四甲基庚烷;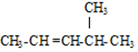 的名称是4-甲基-2-戊烯;
的名称是4-甲基-2-戊烯; ,则键线式为
,则键线式为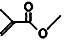 的物质的分子式为C5H8O2;
的物质的分子式为C5H8O2; 的一氯代物有5种;
的一氯代物有5种;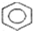 -CH2-C≡CCH2-CH3,其中共平面的碳原子最多可能有15个.
-CH2-C≡CCH2-CH3,其中共平面的碳原子最多可能有15个.
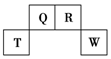 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等.
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等. .用化学方程式表示工业常用冶炼T单质的原理是2Al2O3(熔融)$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑.
.用化学方程式表示工业常用冶炼T单质的原理是2Al2O3(熔融)$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑. .
.