题目内容
13.下列说法不正确的是( )| A. | 0.1mol/L的Na2CO3溶液加适量水稀释后,溶液中$\frac{c(O{H}^{-})}{c(C{O}_{3}^{2-})}$变大 | |
| B. | 若使Na2S溶液中$\frac{c(N{a}^{+})}{c({S}^{2-})}$接近于2:1,可加入适量的KOH固体 | |
| C. | 0.1mol/LNaOH溶液和0.2mol/LCH3COOH溶液等体积混合后溶液中各离子浓度由大到小的顺序是c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| D. | 已知0.1mol/L NaH2PO4水溶液显酸性,则溶液里各种离子浓度由大到小的顺序是c(Na+)>c(H2PO4-)>c(HPO42-)>c(H+)>c(PO43-)>c(OH-) |
分析 A、Na2CO3溶液加适量水稀释后,促进水解,所以氢氧根离子浓度变大,碳酸根离子浓度减小;
B、适量KOH固体,水解平衡向着逆向移动,使得S2-的物质的量增大,而钠离子的物质的量不变;
C、0.1mol/LNaOH溶液和0.2mol/LCH3COOH溶液等体积混合后,得到等物质的量浓度的醋酸和醋酸钠的混合溶液,醋酸的电离程度大于醋酸钠的水解程度;
D、NaH2PO4水溶液显酸性,说明电离程度大于水解程度,所以c(Na+)>c(H2PO4-)>c(H+)>c(HPO42-)>c(PO43-)>c(OH-).
解答 解:A、Na2CO3溶液加适量水稀释后,促进水解,所以氢氧根离子浓度变大,碳酸根离子浓度减小,所以溶液中$\frac{n(O{H}^{-})}{n(C{O}_{3}^{2-})}$变大,则$\frac{c(O{H}^{-})}{c(C{O}_{3}^{2-})}$变大,故A正确;
B、适量KOH固体,水解平衡向着逆向移动,使得S2-的物质的量增大,而钠离子的物质的量不变,从而可使Na2S溶液中$\frac{c(N{a}^{+})}{c({S}^{2-})}$接近于2:1,故B正确;
C、0.1mol/LNaOH溶液和0.2mol/LCH3COOH溶液等体积混合后,得到等物质的量浓度的醋酸和醋酸钠的混合溶液,醋酸的电离程度大于醋酸钠的水解程度,溶液呈酸性,所以离子浓度大小的顺序为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故C正确;
D、NaH2PO4水溶液显酸性,说明电离程度大于水解程度,所以c(Na+)>c(H2PO4-)>c(H+)>c(HPO42-)>c(PO43-)>c(OH-),故D错误;
故选D.
点评 本题考查盐类水解,根据溶液中的溶质及其溶液酸碱性来分析解答,根据电荷守恒、物料守恒确定离子浓度大小,注意水解平衡的移动,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 该溶液中,H+、NH4+、SO42-、I-可以大量共存 | |
| B. | 该溶液中,Ag+、K+、NO3-、NH4+可以大量共存 | |
| C. | 该溶液中,Fe2+、Fe3+、Cl-、NO3-可以大量共存 | |
| D. | 向该溶液中加入浓盐酸,每产生1 molCl2,转移电子约为6.02×1023个 |
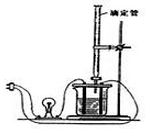 利用如图装置做下面的实验:在烧杯里盛半杯0.1mol/L乙溶液,然后用滴定管向容器里滴入0.1mol/L甲溶液.随着甲的滴入,电灯渐渐变暗亮,滴到一定量后,继续滴入甲溶液,电灯又会逐渐变暗.下列各组溶液中(甲在前,乙在后),能够产生上述现象的是( )
利用如图装置做下面的实验:在烧杯里盛半杯0.1mol/L乙溶液,然后用滴定管向容器里滴入0.1mol/L甲溶液.随着甲的滴入,电灯渐渐变暗亮,滴到一定量后,继续滴入甲溶液,电灯又会逐渐变暗.下列各组溶液中(甲在前,乙在后),能够产生上述现象的是( )| A. | NH3•H2O、AgNO3 | B. | CH3COOH、NH3•H2O | C. | NaOH、AlCl3 | D. | H2SO4、Ba(OH)2 |
| A. | 0.1mol O2完全反应时,转移的电子数为0.4NA | |
| B. | 用惰性电极点解CuSO4溶液后,如果加入0.1mol Cu(OH)2能使溶液复原,则电路中转移电子的数目为0.2NA | |
| C. | 含1mol FeCl3的饱和溶液最多可形成胶体粒子数为NA | |
| D. | 1mol 葡萄糖与足量的钠反应能产生2.5mol H2 |
 的名称是3,3,5,5-四甲基庚烷;
的名称是3,3,5,5-四甲基庚烷;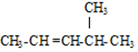 的名称是4-甲基-2-戊烯;
的名称是4-甲基-2-戊烯; ,则键线式为
,则键线式为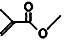 的物质的分子式为C5H8O2;
的物质的分子式为C5H8O2; 的一氯代物有5种;
的一氯代物有5种; -CH2-C≡CCH2-CH3,其中共平面的碳原子最多可能有15个.
-CH2-C≡CCH2-CH3,其中共平面的碳原子最多可能有15个.