题目内容
12.已知醋酸酸性强于氢氰酸酸性,用0.01mol•L-1NaOH溶液完全中和pH相同的下列溶液各100mL,需NaOH溶液体积最大的是( )| A. | 盐酸 | B. | 醋酸 | C. | 氢氰酸 | D. | 硫酸 |
分析 pH相同的各酸溶液中c(H+)相同,盐酸、硫酸都是强酸,完全电离,醋酸和氢氰酸为弱酸,溶液中只有部分发生电离,据此分析pH相同的各酸溶液的物质的量浓度,并据此分析所消耗的碱的体积.
解答 解:pH相同的各酸溶液中c(H+)相同,盐酸、硫酸都是强酸,完全电离,即溶液中无溶质分子;而醋酸和氢氰酸为弱酸,溶液中只有部分发生电离,溶液中存在未电离的溶质分子,且酸性越弱,电离程度越小,溶液中的溶质分子浓度越高,即pH相同的酸溶液,酸的酸性越弱,则酸溶液的浓度越大,当体积均为100mL时,酸的物质的量越大,则消耗的氢氧化钠溶液的体积越大,而酸性最弱的是氢氰酸,故氢氰酸消耗的氢氧化钠溶液的体积最大,故选C.
点评 本题考查了酸性强弱对消耗的碱的体积的影响,难度不大,应注意的是等pH的酸和等浓度的酸在消耗碱的体积方面的区别.

练习册系列答案
相关题目
2.下列有关说法不正确的是( )
| A. | 除去镁粉中混有的少量铝粉,可加入过量的氢氧化钠溶液,完全反应后过滤 | |
| B. | 用明矾净水是因为Al3+水解生成的胶状Al(OH)3具有很强的吸附性 | |
| C. | 在相同浓度的盐酸中,纯铁比含碳量较高的生铁反应速率快 | |
| D. | 冶金工业中可以利用铝热反应原理冶炼钒、铬、锰等金属 |
7.在一定条件下,将3mol A和1mol B两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A (g)+B(s)?xH(g)+2G(g),2min末该反应达到平衡,生成0.8mol G,并测得H的浓度为0.2mol•L-1.下列判断正确的是( )
| A. | x=2 | |
| B. | 2 min内A的反应速率为0.3 mol•(L•min)-1 | |
| C. | 维持其他条件不变,将该混合物转移到固定容积为1 L的密闭容器中,再次平衡后H的浓度将大于0.4 mol•L-1 | |
| D. | 维持其他条件不变,再向容器中加入足量物质 A,最终H的浓度将达到0.5 mol•L-1 |
17.下列各组中的离子,能在酸性溶液中大量共存的是( )
| A. | Na+、Al3+、SO42-、Cl- | B. | Na+、Fe2+、SO42-、NO3- | ||
| C. | Al3+、Na+、Cl-、AlO2- | D. | K+、Cu2+、OH-、SO42- |
 的名称是3,3,5,5-四甲基庚烷;
的名称是3,3,5,5-四甲基庚烷;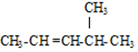 的名称是4-甲基-2-戊烯;
的名称是4-甲基-2-戊烯; ,则键线式为
,则键线式为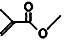 的物质的分子式为C5H8O2;
的物质的分子式为C5H8O2; 的一氯代物有5种;
的一氯代物有5种;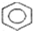 -CH2-C≡CCH2-CH3,其中共平面的碳原子最多可能有15个.
-CH2-C≡CCH2-CH3,其中共平面的碳原子最多可能有15个.