题目内容
下列图示与对应的叙述相符的是( )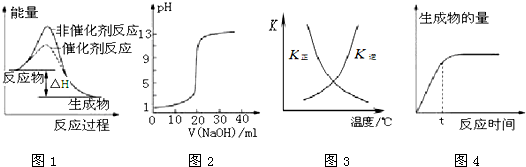

| A、图1表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| B、图2表示0.1000 mol?L-1NaOH溶液滴定20.00mL 0.1000 mol?L-1CH3COOH溶液所得到的滴定曲线 |
| C、图3表示恒容密闭容器中反应“2SO2(g)+O2(g)?2SO3(g)△H<0”的平衡常数K正、K逆随温度的变化 |
| D、图4 表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时反应物转化率最大 |
考点:反应热和焓变,化学平衡常数的含义,物质的量或浓度随时间的变化曲线,中和滴定
专题:图示题
分析:A、图1是放热反应;
B、醋酸是弱酸,醋酸钠溶液显碱性;
C、正反应是放热反应,温度升高K正减小,K逆增大;
D、可逆反应达到平衡时反应物的转化率最大.
B、醋酸是弱酸,醋酸钠溶液显碱性;
C、正反应是放热反应,温度升高K正减小,K逆增大;
D、可逆反应达到平衡时反应物的转化率最大.
解答:
解:A、反应物的总能量大于生成物的总能量为放热反应,因此图象表示故表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化,故A错误;
B、0.1000mol?L-1 NaOH溶液滴定20.00mL 0.1000mol?L-1 CH3COOH溶液消耗20ml溶液恰好反应生成醋酸钠,溶液呈碱性,故B错误;
C、正反应是放热反应,温度升高,平衡逆向移动,K正减小,K逆和K正互为倒数,故C正确;
D、可逆反应达到平衡时反应物转化率最大,t时还没有达到化学平衡状态,故D错误.
故选:C.
B、0.1000mol?L-1 NaOH溶液滴定20.00mL 0.1000mol?L-1 CH3COOH溶液消耗20ml溶液恰好反应生成醋酸钠,溶液呈碱性,故B错误;
C、正反应是放热反应,温度升高,平衡逆向移动,K正减小,K逆和K正互为倒数,故C正确;
D、可逆反应达到平衡时反应物转化率最大,t时还没有达到化学平衡状态,故D错误.
故选:C.
点评:本题考查反应热和焓变、中和滴定、化学平衡常数、转化率与化学平衡的关系,题目难度中等,侧重于运用所学原理从图象中获取信息、分析问题、解决问题的能力.

练习册系列答案
相关题目
下列关于化学键的说法不正确的是( )
| A、化学键是一种作用力 |
| B、化学键可以是原子间作用力,也可以是离子间作用力 |
| C、化学键存在于分子内部 |
| D、化学键存在于分子之间 |
镍铬(Ni-Cd)可充电电池的电解质溶液为KOH溶液,它的充、放电反应按下式进行:
Cd+2NiOOH+2H2O
Cd(OH)2+2Ni(OH)2
已知Ni(OH)2、Cd(OH)2和NiOOH都不溶于KOH溶液.则下列有关电极反应式正确的是( )
Cd+2NiOOH+2H2O
| ||
已知Ni(OH)2、Cd(OH)2和NiOOH都不溶于KOH溶液.则下列有关电极反应式正确的是( )
| A、放电时负极:Cd-2e-=Cd2+ |
| B、充电时阳极:Cd(OH)2+2e-=Cd+2OH- |
| C、充电时阳极:2Ni(OH)2-2e-+4H+=2Ni3++4H2O |
| D、放电时正极:2NiOOH+2e-+2H2O=2Ni(OH)2+2OH- |
下列溶液中各微粒的浓度关系错误的是( )
| A、0.1 mol?L-1NaHS溶液:c(OH-)+c(S2-)=c(H2S )+c(H+) |
| B、0.1 mol?L-1NaHCO3溶液:c(Na+)>c(HCO3-)>c(OH-)>c(CO32-)>c(H+) |
| C、Na2CO3溶液:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
| D、0.1 mol?L-1氨水:c(NH4+)+c(H+)=c(OH-) |
8.8g FeS与400mL 1mol/L硝酸溶液恰好完全反应,反应后产物为Fe2(SO4)3和Fe(NO3)3、X、H2O,则X为( )
| A、N2 |
| B、N2O |
| C、NO |
| D、NO2 |
下列说法或表达正确的是( )
| A、CH3COONa溶液中加入少量KNO3固体后的碱性溶液一定有:C(Na+)-c(CH3COO-)=c(OH-)-c(H+) |
| B、向ZnS白色悬浊液中加入CuSO4溶液,有黑色沉淀产生,是因为Ksp(ZnS)<Ksp(CuS) |
| C、向沸腾的NaOH溶液中滴加FeCl3饱和溶液,可以制备Fe(OH)3胶体 |
| D、热水中加入NaCl溶解至饱和后溶液的pH等于7 |
下列说法正确的是( )
| A、能电离出H+的化合物就是酸 |
| B、在水溶液里或熔融状态下能导电的物质是电解质 |
| C、离子方程式Cu2++2OH-=Cu(OH)2↓只能表示一个化学反应 |
| D、溶液、胶体和浊液最本质的区别是分散质粒子的大小不同 |
下列说法错误的是( )
| A、从1L1mol/L的氯化钠溶液中取出10ml,其浓度仍是1mol/L |
| B、制成0.5L10mol/L的盐酸,需要氯化氢气体112L(标准状况) |
| C、同温同压下,体积相同的O2和O3所含的原子数相等 |
| D、0.5 L 2mol/L的氯化钡溶液中,钡离子和氯离子总数约为3×6.02×1023 |
用于净化汽车尾气的反应:2NO(g)+2CO(g)?2CO2(g)+N2(g),已知该反应的平衡常数极大(570K时为1×1059),但反应速率极慢.下列说法正确的是( )
| A、反应中NO作氧化剂,N2是氧化产物 |
| B、装有尾气净化装置的汽车排出的气体中不再含有NO或CO |
| C、提高尾气净化效率的最佳途径是使用高效催化剂 |
| D、增大压强,上述平衡右移,故可通过增压的方法提高尾气净化效率 |