题目内容
下列说法错误的是( )
| A、从1L1mol/L的氯化钠溶液中取出10ml,其浓度仍是1mol/L |
| B、制成0.5L10mol/L的盐酸,需要氯化氢气体112L(标准状况) |
| C、同温同压下,体积相同的O2和O3所含的原子数相等 |
| D、0.5 L 2mol/L的氯化钡溶液中,钡离子和氯离子总数约为3×6.02×1023 |
考点:物质的量浓度
专题:物质的量浓度和溶解度专题
分析:A、溶液是均一稳定的分散系;
B、依据n=CV计算溶质物质的量,结合n=
计算氯化氢气体体积;
C、依据阿伏伽德罗定律分析判断,同温、同压、同体积气体分子数相同;
D、依据n=CV计算溶质物质的量,结合溶质组成计算离子数;
B、依据n=CV计算溶质物质的量,结合n=
| V |
| 22.4 |
C、依据阿伏伽德罗定律分析判断,同温、同压、同体积气体分子数相同;
D、依据n=CV计算溶质物质的量,结合溶质组成计算离子数;
解答:
解:A、溶液是均一稳定的分散系,从1L1mol/L的氯化钠溶液中取出10ml,其浓度仍是1mol/L,故A正确;
B、依据n=CV计算溶质物质的量=0.5L×10mol/L=5mol,结合n=
计算氯化氢气体体积,V=5mol×22.4L/mol=112L,故B正确;
C、依据阿伏伽德罗定律分析判断,同温、同压、同体积气体分子数相同,O2和O3所含的原子数不同,故C错误;
D、依据n=CV计算溶质物质的量=0.5 L×2mol/L=1mol,结合溶质组成计算离子数钡离子和氯离子总数约为3×6.02×1023,故D正确;
故选C.
B、依据n=CV计算溶质物质的量=0.5L×10mol/L=5mol,结合n=
| V |
| 22.4 |
C、依据阿伏伽德罗定律分析判断,同温、同压、同体积气体分子数相同,O2和O3所含的原子数不同,故C错误;
D、依据n=CV计算溶质物质的量=0.5 L×2mol/L=1mol,结合溶质组成计算离子数钡离子和氯离子总数约为3×6.02×1023,故D正确;
故选C.
点评:本题考查了物质的量浓度、气体体积、阿伏伽德罗定律的分析应用,主要是物理量间的换算关系,掌握基础是关键,题目较简单.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
下列关于铷的叙述中不正确的是( )
| A、它位于周期表的第四周期、第ⅠA族 |
| B、在钠、钾、铷三种单质中,铷的熔点最低 |
| C、氢氧化铷是强碱 |
| D、硝酸铷是离子化合物 |
下列图示与对应的叙述相符的是( )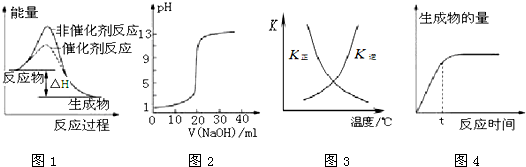

| A、图1表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| B、图2表示0.1000 mol?L-1NaOH溶液滴定20.00mL 0.1000 mol?L-1CH3COOH溶液所得到的滴定曲线 |
| C、图3表示恒容密闭容器中反应“2SO2(g)+O2(g)?2SO3(g)△H<0”的平衡常数K正、K逆随温度的变化 |
| D、图4 表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时反应物转化率最大 |
设nA代表阿伏加德罗常数(NA)的数值,下列说法正确的是( )
| A、1 mol硫酸钾中阴离子所带电荷数为nA |
| B、常温常压下,CO和N2组成的28 g混合气体中含有3nA个原子 |
| C、标准状况下,2.24 L氯气与足量氢氧化钠溶液反应转移的电子数为0.2nA |
| D、将0.1 mol氯化铁溶于1 L水中,所得溶液含有Fe3+个数少于0.1nA |
下列各组气体中,在通常条件下能稳定共存的是( )
| A、NH3、O2、HCl |
| B、N2、H2、HCl |
| C、CO2、NO、O2 |
| D、SO2、H2S、H2 |
下列说法中,正确的是( )
| A、SO2水溶液能导电,所以SO2是电解质 |
| B、Na2CO3既是钠盐又是碳酸盐 |
| C、向醋酸溶液中加入少量氢氧化钠固体,由于发生中和反应,溶液的导电能力降低 |
| D、NaCl溶液能导电所以NaCl溶液是电解质 |
下列实验会产生所描述现象的是( )
| A、将少量新制氯水加入KI溶液中,再加入CCl4,振荡、静置后有紫色沉淀析出 |
| B、将SO2气体通入BaCl2溶液中,有白色沉淀产生 |
| C、将铜片加入浓硫酸中加热,有红棕色气体产生 |
| D、将Na2CO3粉末加入新制饱和氯水中,有气体产生 |
在下列化学反应中,既有离子键、共价键断裂,又有离子键、共价键形成的是( )
| A、2Na+2H2O=2NaOH+H2↑ |
| B、SO2+2H2S=3S+2H2O |
| C、Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑ |
| D、BaCl2+Na2SO4=BaSO4↓+2NaCl |