题目内容
下列说法正确的是( )
| A、能电离出H+的化合物就是酸 |
| B、在水溶液里或熔融状态下能导电的物质是电解质 |
| C、离子方程式Cu2++2OH-=Cu(OH)2↓只能表示一个化学反应 |
| D、溶液、胶体和浊液最本质的区别是分散质粒子的大小不同 |
考点:电解质与非电解质,离子方程式的书写
专题:离子反应专题
分析:A.能够电离出氢离子的物质不一定为酸,如硫酸氢钠、水等都能够电离出氢离子;
B.电解质必须是化合物,单质和混合物一定不是电解质;
C.该反应表示的是一类反应,如氯化铜与氢氧化钠溶液、硝酸铜与氢氧化钾溶液的反应等;
D.根据分散系的分类依据进行判断.
B.电解质必须是化合物,单质和混合物一定不是电解质;
C.该反应表示的是一类反应,如氯化铜与氢氧化钠溶液、硝酸铜与氢氧化钾溶液的反应等;
D.根据分散系的分类依据进行判断.
解答:
解:A.酸能够电离出氢离子,但是能够电离出氢离子的不一定为酸,如硫酸氢钠、亚硫酸氢钠等酸式盐能够电离出氢离子,但是它们属于盐,故A错误;
B.在水溶液或熔融状态下能够导电的化合物为电解质,单质和混合物一定不是电解质和非电解质,故B错误;
C.离子方程式Cu2++2OH-=Cu(OH)2↓表示的是一类反应,只要是含有可溶性铜离子的物质与强碱溶液反应生成氢氧化铜沉淀和可溶性盐的反应,都可以用该反应表示,故C错误;
D.分散质粒子在1-100nm的为胶体,分散质粒子小于1nm的溶液,大于100nm的为浊液,所以溶液、胶体和浊液的根本区别为分散质粒子的大小,故D正确;
故选D.
B.在水溶液或熔融状态下能够导电的化合物为电解质,单质和混合物一定不是电解质和非电解质,故B错误;
C.离子方程式Cu2++2OH-=Cu(OH)2↓表示的是一类反应,只要是含有可溶性铜离子的物质与强碱溶液反应生成氢氧化铜沉淀和可溶性盐的反应,都可以用该反应表示,故C错误;
D.分散质粒子在1-100nm的为胶体,分散质粒子小于1nm的溶液,大于100nm的为浊液,所以溶液、胶体和浊液的根本区别为分散质粒子的大小,故D正确;
故选D.
点评:本题考查了电解质、酸、分散系的分类方法判断及离子方程式的书写方法等知识,题目难度中等,浊液掌握电解质与非电解质的概念、分散系的分类及各分散系的根本区别,明确离子方程式的书写原则.

练习册系列答案
相关题目
L-T 5种短周期元素的信息如表,有关叙述正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、+4、-2 | -2 |
| A、与稀盐酸反应的剧烈程度:L单质<Q单质 |
| B、热稳定性:H2T<H2R |
| C、沸点:H2T>H2R |
| D、L2+与R2-的核外电子数相等 |
在容积固定不变的密闭容器中加入1mol N2和3mol H2发生反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1,下列结论正确的是( )
| A、该反应达到平衡时,放出的热量等于92.4kJ |
| B、达到平衡后向容器中通入1mol氦气,平衡正向移动 |
| C、若达到平衡时N2的转化率为20%,则平衡时容器内的压强是起始时的80% |
| D、若达到平衡时N2的转化率为20%,则平衡时容器内的压强是起始时的90% |
下列图示与对应的叙述相符的是( )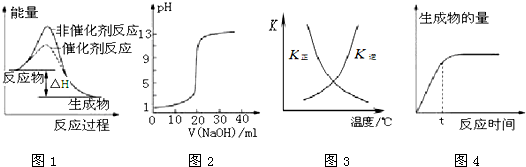

| A、图1表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| B、图2表示0.1000 mol?L-1NaOH溶液滴定20.00mL 0.1000 mol?L-1CH3COOH溶液所得到的滴定曲线 |
| C、图3表示恒容密闭容器中反应“2SO2(g)+O2(g)?2SO3(g)△H<0”的平衡常数K正、K逆随温度的变化 |
| D、图4 表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时反应物转化率最大 |
汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3=K2O+5Na2O+16N2↑.若氧化产物比还原产物多1.75mol,则下列判断不正确的是( )
| A、生成44.8 L N2(标准状况) |
| B、有0.250 mol KNO3被氧化 |
| C、转移电子的物质的量为1.25 mol |
| D、被氧化的N原子的物质的量为3.75 mol |
设nA代表阿伏加德罗常数(NA)的数值,下列说法正确的是( )
| A、1 mol硫酸钾中阴离子所带电荷数为nA |
| B、常温常压下,CO和N2组成的28 g混合气体中含有3nA个原子 |
| C、标准状况下,2.24 L氯气与足量氢氧化钠溶液反应转移的电子数为0.2nA |
| D、将0.1 mol氯化铁溶于1 L水中,所得溶液含有Fe3+个数少于0.1nA |
下列说法中,正确的是( )
| A、SO2水溶液能导电,所以SO2是电解质 |
| B、Na2CO3既是钠盐又是碳酸盐 |
| C、向醋酸溶液中加入少量氢氧化钠固体,由于发生中和反应,溶液的导电能力降低 |
| D、NaCl溶液能导电所以NaCl溶液是电解质 |
下列各选项中的两种物质或粒子互为同位素的是( )
| A、O2和O3 |
| B、金刚石和石墨 |
| C、H2O和H2O2 |
| D、2412Mg和2612Mg |