题目内容
下列关于化学键的说法不正确的是( )
| A、化学键是一种作用力 |
| B、化学键可以是原子间作用力,也可以是离子间作用力 |
| C、化学键存在于分子内部 |
| D、化学键存在于分子之间 |
考点:化学键
专题:化学键与晶体结构
分析:化学键是相邻原子或离子之间强烈的相互作用,化学键是一种作用力,离子键和共价键、金属键都属于化学键.
解答:
解:A.化学键是相邻原子或离子之间强烈的作用力,故A正确;
B.化学键可以是原子之间的作用力,如共价化合物和多原子分子的单质等,也可以是离子之间的作用力,如离子晶体中阴阳离子之间的作用力,故B正确;
C.化学键存在于分子内,存在于相邻原子之间,故C正确;
D.分子之间的作用力是范德华力,不是化学键,故D错误;
故选D.
B.化学键可以是原子之间的作用力,如共价化合物和多原子分子的单质等,也可以是离子之间的作用力,如离子晶体中阴阳离子之间的作用力,故B正确;
C.化学键存在于分子内,存在于相邻原子之间,故C正确;
D.分子之间的作用力是范德华力,不是化学键,故D错误;
故选D.
点评:本题考查了化学键的判断,明确化学键的概念是解本题关键,注意化学键中的几个关键词“相邻”、“强烈的相互作用”,题目难度不大.

练习册系列答案
相关题目
 在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如图所示,有关粒子浓度关系正确的是( )
在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如图所示,有关粒子浓度关系正确的是( )| A、在A、B间任一点,溶液中一定都有c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| B、在B点,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+) |
| C、在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| D、在D点:c(CH3COO-)+c(CH3COOH)=c(Na+) |
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、1 mol N2所含有的原子数为NA |
| B、标准状况下,16 g NH3中含有的分子数为NA |
| C、标准状况下,22.4 L氯化氢所含的原子数为NA |
| D、500 mL 1.0 mol?L-1硫酸钠溶液中所含的钠离子数为NA |
与乙炔具有相同的碳、氢物质的量百分比,但一定既不是它的同系物又不是它的同分异构体的是( )
| A、丙炔 |
| B、乙烯 |
| C、C4H6 |
| D、苯 |
上海自主研发了一种氢燃料汽车.它是以30%KOH溶液为电解质的氢氧燃料电池,下列有关说法中,不正确的是( )
| A、正极反应:O2+2H2O+4e-═4OH- |
| B、发生氧化反应的是负极 |
| C、当正极消耗22.4LH2时,负极11.2LO2消耗(相同条件) |
| D、氢氧燃料电池不仅能量转化率高,而且产物是水,属于环境友好电池 |
下列叙述正确的是( )
| A、NaCl溶液在电流作用下电离成Na+与Cl- |
| B、溶于水后能电离出H+的化合物都是酸 |
| C、液态氯化氢不能导电,但氯化氢是电解质 |
| D、导电性强的溶液里自由移动离子数目一定比导电性弱的溶液里自由移动离子数目多 |
L-T 5种短周期元素的信息如表,有关叙述正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、+4、-2 | -2 |
| A、与稀盐酸反应的剧烈程度:L单质<Q单质 |
| B、热稳定性:H2T<H2R |
| C、沸点:H2T>H2R |
| D、L2+与R2-的核外电子数相等 |
下列关于铷的叙述中不正确的是( )
| A、它位于周期表的第四周期、第ⅠA族 |
| B、在钠、钾、铷三种单质中,铷的熔点最低 |
| C、氢氧化铷是强碱 |
| D、硝酸铷是离子化合物 |
下列图示与对应的叙述相符的是( )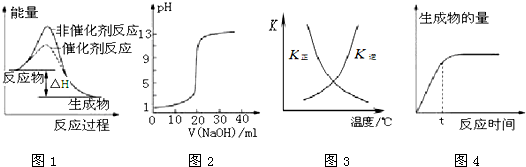

| A、图1表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| B、图2表示0.1000 mol?L-1NaOH溶液滴定20.00mL 0.1000 mol?L-1CH3COOH溶液所得到的滴定曲线 |
| C、图3表示恒容密闭容器中反应“2SO2(g)+O2(g)?2SO3(g)△H<0”的平衡常数K正、K逆随温度的变化 |
| D、图4 表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时反应物转化率最大 |