题目内容
2.下列说法不正确的是( )| A. | 12C与14C为不同核素 | B. | 石墨和C60互为同素异形体 | ||
| C. | O2和O3互为同位素 | D. | ${\;}_{17}^{35}$X与${\;}_{17}^{37}$Y 为同种元素 |
分析 A.质子数和中子数一定的原子为元素的核素;
B.同种元素组成的不同单质为同分异构体;
C.二者为氧元素的不同单质,互为同素异形体;
D.质子数相同的同类原子总称为元素.
解答 解:A.12C与14C具有一定质子数和中子数的原子为不同核素,故A正确;
B.石墨和C60是同种碳元素组成的不同单质,为同素异形体,故B正确;
C.O2和O3为O元素的不同单质,二者互为同素异形体,故C错误;
D.二者质子数相同,为同种元素,故D正确;
故选C.
点评 本题考查原子结构、同位素、核素、同素异形体等的理解应用,题目难度不大,注意掌握同位素、核素、同素异形体等概念,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
13.短周期主族元素X、Y、Z、W的原子序数依次增大,X和W同主族且W的单质是重要的半导体材料,Y原子的最外层电子数是其内层电子数的3倍,Z2+与Y2-核外电子排布相同.下列说法正确的是( )
| A. | X的氢化物中仅含有极性键 | |
| B. | X与Y形成的三原子分子的电子式是 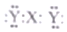 | |
| C. | 原子半径Z>Y,离子半径Z2+<Y2- | |
| D. | X、Y的非金属性强弱可用其氧化物的水化物的酸性强弱来推断 |
10.对于100mL1mol/L盐酸与铁片的反应,采取下列措施,其中不能使反应速率加快的是( )
| A. | 升高温度 | B. | 改用50mL2mol/L盐酸 | ||
| C. | 改用200mL1mol/L盐酸 | D. | 用等量铁粉代替铁片 |
17.下列变化中,不需要破坏化学键的是( )
| A. | HCl溶于水 | B. | 食盐熔融 | C. | 碘单质溶于苯 | D. | 石油裂化 |
7.已知1-18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,则下列叙述或表示方法正确的是( )
| A. | 四种元素位于同一周期 | B. | 氢化物的稳定性:H2Y>HZ | ||
| C. | 原子序数a>b>d>c | D. | a+3=c-2 |
14.液化气的主要成分是丙烷,下列有关丙烷的叙述不正确的是( )
| A. | 是直链烃,但分子中3个碳原子不在一条直线上 | |
| B. | 在光照条件下能够与氯气发生取代反应 | |
| C. | 丙烷比丁烷沸点高 | |
| D. | 1 mol丙烷完全燃烧消耗5 mol O2 |
11.下列反应的离子方程式正确的是( )
| A. | 用KIO3 氧化酸性溶液中的KI:5I-+IO3-+3H2O═3I2+6OH- | |
| B. | 向Ca(ClO)2溶液中通入过量CO2制次氯酸:ClO-+H2O+CO2═HClO+HCO3- | |
| C. | 向酸性KMnO 4溶液中滴入H 2O2:2MnO 4-+6H++3H2O2═2Mn 2++4O2↑+6H2O | |
| D. | 用Cl2与石灰乳反应制漂白粉:Cl2+2OH-═Cl-+ClO-+H2O |
12.室温时,在由水电离出c(OH-)=1.0×10-12mol•L-1的溶液中,一定能大量共存的离子组是( )
| A. | K+、Na+、HCO3-、Cl- | B. | K+、MnO4-、Br-、Cl- | ||
| C. | Na+、Cl-、NO3-、SO42- | D. | Al3+、NH4+、Cl-、SO42- |