题目内容
18.下列各式表示水解反应的是( )| A. | HCO3-+H2O?H3O++CO32- | B. | HS-+H2O?H2S+OH- | ||
| C. | HSO3-+H2O?SO32-+H3O+ | D. | HCO3-+OH-?H2O+CO32- |
分析 水解反应的实质是:弱酸或弱碱离子结合水电离出的氢离子或氢氧根离子生成弱电解质的过程,水解反应方程式用可逆符号表示,以此分析得出正确结论.
解答 解:A、HCO3-+H2O?H3O++CO32-,是碳酸氢根离子的电离方程式,不是水解离子方程式,故A错误;
B、HS-+H2O?H2S+OH-,是硫氢根离子的水解离子方程式,故B正确;
C、HSO3-+H2O?SO32-+H3O+,是亚硫酸氢根离子的电离方程式,故C错误;
D、HCO3-+OH-?H2O+CO32-,是碳酸氢根离子和氢氧根离子发生的复分解反应,故D错误;
故选B.
点评 本题考查学生对水解反应原理的理解,题目难度不大,明确水解的反应原理是解答本题的关键,注意区分反应、水解和电离.

练习册系列答案
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案
相关题目
9.X、Y、Z、W是原子序数依次增大的不同主族短周期元素,其中两种为金属元素,X原子的最外层电子数与次外层电子数相等,X与W、Y与Z这两对原子的最外层电子数之和均为9.下列说法正确的是( )
| A. | Y、Z、W的简单离子半径Z>W>Y | B. | 工业上制取Y可用电解YW3制得 | ||
| C. | XW2中各原子均达到8电子结构 | D. | Z、W的氧化物对应水化物的酸性Z<W |
6.多巴胺的一种合成路线如图所示:

下列说法正确的是( )

下列说法正确的是( )
| A. | 原料甲与苯酚互为同系物 | |
| B. | 中间产物乙、丙和多巴胺都具有两性 | |
| C. | 多巴胺不可能存在氨基酸类的同分异构体 | |
| D. | 1 mol甲最多可以和2 mol Br2发生取代反应 |
13.短周期主族元素X、Y、Z、W的原子序数依次增大,X和W同主族且W的单质是重要的半导体材料,Y原子的最外层电子数是其内层电子数的3倍,Z2+与Y2-核外电子排布相同.下列说法正确的是( )
| A. | X的氢化物中仅含有极性键 | |
| B. | X与Y形成的三原子分子的电子式是 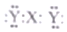 | |
| C. | 原子半径Z>Y,离子半径Z2+<Y2- | |
| D. | X、Y的非金属性强弱可用其氧化物的水化物的酸性强弱来推断 |
3.下列说法中,正确的是( )
| A. | 二氧化硅可用来制造太阳能电池 | |
| B. | 需要加热才能进行的反应一定是吸热反应 | |
| C. | 铜的金属性比铝弱,可以用铜罐贮运浓硝酸 | |
| D. | NaOH溶液不能保存在带磨口玻璃塞的试剂瓶中 |
10.对于100mL1mol/L盐酸与铁片的反应,采取下列措施,其中不能使反应速率加快的是( )
| A. | 升高温度 | B. | 改用50mL2mol/L盐酸 | ||
| C. | 改用200mL1mol/L盐酸 | D. | 用等量铁粉代替铁片 |
7.已知1-18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,则下列叙述或表示方法正确的是( )
| A. | 四种元素位于同一周期 | B. | 氢化物的稳定性:H2Y>HZ | ||
| C. | 原子序数a>b>d>c | D. | a+3=c-2 |
8.下列叙述中正确的是( )
| A. | 某ⅡA族元素的原子序数为a,则原子序数为a+1的元素一定是ⅢA族元素 | |
| B. | 除短周期外,其他周期均有32种元素 | |
| C. | 原子最外层只有2个电子的元素可能是金属元素也可能是非金属元素 | |
| D. | 碱金属元素是指ⅠA族的所有元素 |
